
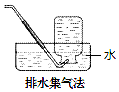
| A. | NO2 | B. | O2 | C. | SO2 | D. | NH3 |
分析 常用的有排水法和排空气法,若密度比空气的大,采用向上排空气法,若密度比空气的小,采用向下排空气法.能用排水法收集说明该气体难溶于水,和水也不反应.
A.二氧化氮和水反应;
B.氧气难溶于水;
C.二氧化硫易溶于水;
D.氨气极易溶于水.
解答 解:A.二氧化氮和水反应生成硝酸和一氧化氮,不能用排水法收集,故A错误;
B.氧气难溶于水,可以用排水取气法收集,故B正确;
C.二氧化硫易溶于水和水反应生成亚硫酸,不能用排水法收集,故C错误;
D.氨气极易溶于水,不能用排水法收集,故D错误;
故选B.
点评 本题考查气体的收集方法,应熟悉常用的气体收集方法,排空气法要根据气体的密度来确定,但排空气法收集的气体不是很纯;气体用排水法收集的较纯,能用排水法收集说明该气体难溶于水,和水也不反应,题目难度不大.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:选择题
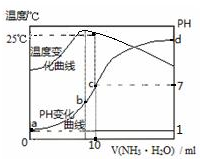
| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH4+)=c(Cl-)=1.0mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)=(n-1)×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
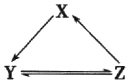 下表所列各组物质中,物质之间通过一步反应不能实砚如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应不能实砚如图所示转化的是( )| 选项 | X | Y | Z |
| A | Na | NaOH | NaCl |
| B | Si | SiO2 | Na2SiO3 |
| C | Cl2 | HClO | NaClO |
| D | NO | NO2 | HNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图(夹持仪器略去),主要步骤如下:
无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图(夹持仪器略去),主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCHO | B. | CH3COOCH2CH3 | C. | HOOCCOOH | D. | HCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | CH3COOH | H2CO3 | HNO2 |
| 电离常数 | K=1.8×10-5 | K=4.3×10-7 K=5.6×10-11 | K=5.0×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.2 mol•L-1蔗糖溶液中所含分子总数为0.02NA | |
| B. | 40mL 10mol•L-1的浓盐酸与足量的MnO2充分反应,生成氯气的分子数为0.1NA | |
| C. | 标准状况下,22.4L CHCl3中含有的氯原子数目为3NA | |
| D. | 14g CO 和N2混合气体中含有的电子总数为7NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com