
| A. | 硫原子的结构示意图: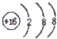 | B. | Na2S的电子式:Na+: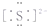 | ||
| C. | HCl的结构式:H-Cl | D. | CH4分子的球模型: |
分析 A.S的质子数为16,核外电子数为16,各层电子数分别为2、8、6,用小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数;
B.硫化钠中存在钠离子和硫离子,钠离子直接用离子符号表示,硫离子需要标出最外层电子及所带电荷;
C.氯化氢属于共价化合物,氢与氯原子之间共用一对电子,结构式用横线表示共用电子对;
D.球棍模型突出的是原子之间的成键的情况及空间结构.
解答 解:A.原子结构示意图中,圆圈表示原子核,圆圈内的数值为质子数,核外电子层用弧线表示,弧线上的数据表示每层的电子数.硫原子的质子数是16,原子结构示意图为: ,故A错误;
,故A错误;
B.Na2S为离子化合物,钠离子用离子符号表示,硫离子标出最外层电子,硫化钠的电子式为: ,故B错误;
,故B错误;
C.氯化氢是共价化合物,氯化氢分子中氢原子最外层两个电子、氯原子达到8电子稳定结构,氯化氢的电子式为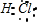 ,用横线表示共用电子对,HCl的结构式:H-Cl,故C正确;
,用横线表示共用电子对,HCl的结构式:H-Cl,故C正确;
D.该图形是甲烷的比例模型,不是球棍模型,球棍模型为: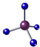 故D错误;
故D错误;
故选C.
点评 本题主要考查了结构示意图、球棍模型、电子式、等书写,题目难度不大,注意把握概念的内涵与外延.


科目:高中化学 来源: 题型:选择题
| A. | 大气中CO2含量的剧增,对自然界中碳及其化合物间的平衡没有影响 | |
| B. | 木炭燃烧过程中,存在碳单质、CO和CO2之间的转化 | |
| C. | 碳的氧化物间的相互转化不属于氧化还原反应 | |
| D. | 含碳的无机化合物和有机化合物之间存在着严格的界限,无机化合物不能合成有机化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 C:CH3CH2OH
C:CH3CH2OH .
. +CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能量变化如图所示的反应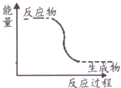 | |
| B. | 中和反应 | |
| C. | 化学键断裂吸收的热量比化学键生成放出的热量少的反应 | |
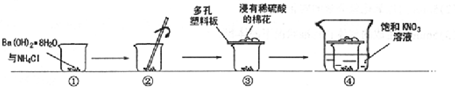
| D. | Ba(OH)2•8H2O晶体和NH4Cl晶体反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:钠>硫>氯 | B. | 氧化性:Na+>K+ | ||
| C. | 最高正化合价:氯>硫>磷 | D. | 酸性:HF>HCl>HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸酸性R>X | B. | 简单氢化物稳定性Y<X | ||
| C. | 最高正化合价Z<X<Y<R | D. | 由Z和R形成的化合物为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
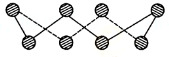 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com