
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | b | ||||||||||||||||
| c | d | e | |||||||||||||||
| f | g | ||||||||||||||||
| M | ||
4
|
| M | ||
4
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.
(2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.
查看答案和解析>>
科目:高中化学 来源:2014届四川昭觉中学高二上学期期中考试化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
a |
|
b |
|
|||||||||
|
|
|
c |
|
|
d |
e |
|
||||||||||
|
|
|
|
|
|
|
|
|
f |
|
g |
|
|
|
|
|
|
|
试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d在空气中燃烧产物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: 。
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。此配合离子空间构型为 ,请写出生成此配合离子的离子方程式: 。
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f3+ 的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
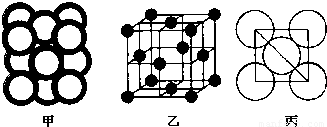
(5)c单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

c单质晶体中原子的配位数为 。若已知c的原子半径为r,NA代表阿伏加德罗常数,c的相对原子质量为M。该晶体的密度为 (用字母表示)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省成都七中高二(上)期中化学试卷(解析版) 题型:填空题
| a | b | ||||||||||||||||
| c | d | e | |||||||||||||||
| f | g | ||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com