
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
| c(CO) |
| c(CO2) |
| c(H2) |
| c(H2O) |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| K2 |
| K1 |
| K2 |
| K1 |
 ;
; ;
;| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |


科目:高中化学 来源: 题型:
| A、气体摩尔体积是指1mol任何气体所占的体积约为22.4L |
| B、一定温度和压强下,各种气态物质所占体积的大小,由构成气体的分子数决定 |
| C、不同的气体,若体积不同,则它们所含的分子数也不同 |
| D、一定温度和压强下,各种气态物质所占体积的大小,由构成气体的分子大小决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
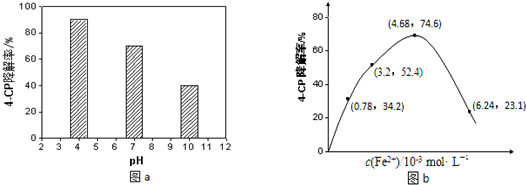
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
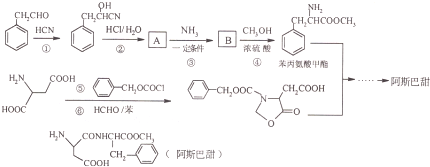
| H+/H2O |

 的合成路线流程(无机试剂任选).合成路线流程示例如下
的合成路线流程(无机试剂任选).合成路线流程示例如下 :
:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com