
关于电解质溶液下列说法中不正确的是
A.向浓度均为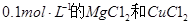 混合溶液中逐滴加入氨水,先生成蓝色
混合溶液中逐滴加入氨水,先生成蓝色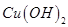 沉淀,则
沉淀,则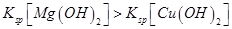
B.用等浓度的NaOH溶液中和等体积pH=2与pH=3的醋酸,所消耗的NaOH溶液的体积前者是后者的10倍
C.由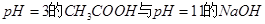 溶液等体积混合,其离子浓度的顺序为:
溶液等体积混合,其离子浓度的顺序为: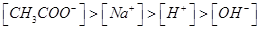
D.某温度下纯水中 ,则该温度下0.1mol/L的盐酸的pH=1
,则该温度下0.1mol/L的盐酸的pH=1
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列关于电解质溶液说法正确的是 ( )
A.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
B..等体积的pH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB
C.常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA‾的电离程度大于其水解程度
D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
| B..等体积的pH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB |
| C.常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA?的电离程度大于其水解程度 |
| D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市启东市高二(上)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com