
分析 (1)Cu与浓硝酸反应生成二氧化氮和硝酸铜溶液;
(2)硝酸盐在酸性条件下具有硝酸的氧化性,则能继续与铜反应;
(3)铜和硝酸反应生成硝酸铜与氮的氧化物(NO或NO2或NO、NO2的混合物),反应中硝酸其氧化剂、酸性作用,起氧化剂作用的硝酸生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,根据氮原子守恒:2n[Cu(NO3)2]+n(NO、NO2),据此计算消耗硝酸的物质的量;
(4)①一氧化氮和二氧化氮是一氧化氮的耗氧量大于二氧化氮,所以如果全是一氧化氮需氧气的量为:$\frac{3×60}{4}$=36mL<40mL O2,所以剩余的气体是氧气;
②根据得失电子守恒列出关系式,求二氧化氮体积;
③剩余20mL气体是一氧化氮,由反应方程式3NO2+H2O═2HNO3+NO,反应生成一氧化氮的二氧化氮是30ml,所以20ml的二氧化氮与氧气反应,消耗氧气的体积为:$\frac{20}{4}$;
④根据c=$\frac{n}{V}$进行计算求解.
解答 解:(1)因反应开始硝酸的浓度大,反应剧烈,反应生成硝酸铜溶液、二氧化氮和水,其反应方程式为Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
(2)硝酸盐在酸性条件下具有硝酸的氧化性,则能与铜与氢离子、硝酸根离子继续反应生成NO,
故答案为:稀硫酸中氢离子和硝酸铜中硝酸根离子又构成硝酸,和铜继续反应;
(3)12.8gCu的物质的量=$\frac{12.8g}{64g/mol}$=0.2mol,气体的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,
根据氮原子守恒,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.25mol=0.65mol,根据得失电子守恒n(NO2)+3n(NO)=2n(Cu)=0.4,而n(NO2)+n(NO)=0.25mol,解之得n(NO2)=0.175mol,故答案为:0.65mol;0.175mol;
(4)①一氧化氮和二氧化氮是一氧化氮的耗氧量大于二氧化氮,所以如果全是一氧化氮需氧气的量为:$\frac{3×60}{4}$=36mL<40mL O2,所以剩余的气体是氧气,故答案为:O2;
②设二氧化氮为xml,V(NO2)+3V(NO)=4V(O2)=4×(40-20),又因为V(NO2)+V(NO)=60,解之得:V(NO)=10ml,V(NO2)=50ml,故答案为:50;
③剩余20mL气体是一氧化氮,由反应方程式3NO2+H2O═2HNO3+NO,反应生成一氧化氮的二氧化氮是30ml,所以20ml的二氧化氮与氧气反应,消耗氧气的体积为:$\frac{20}{4}$=5ml,故答案为:5ml;
④根据c=$\frac{n}{V}$=$\frac{\frac{60×1{0}^{-3}L}{22.4L/mol}}{60×1{0}^{-3}L}$=0.045mol/L,故答案为:0.045.
点评 本题考查硝酸的性质和硝酸盐在酸性条件下的性质,明确铜与浓、稀硝酸反应的化学反应即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
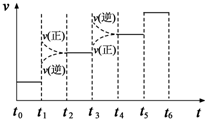 氨是一种重要的化工原料,氨的合成和应用仍是当前的重要研究内容之一.化学方程式为N2(g)+3H2(g)?2NH3(g)△H<0
氨是一种重要的化工原料,氨的合成和应用仍是当前的重要研究内容之一.化学方程式为N2(g)+3H2(g)?2NH3(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠与醋酸反应:HCO3-+H+═CO2↑+H2O | |
| B. | 等物质的量的硫酸氢钠与氢氧化钡溶液:SO42-+H++Ba2++OH-═H2O+BaSO4↓ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 金属钠与H2O 反应:Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20.0% | B. | 38.7% | C. | 50.0% | D. | 81.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5项 | B. | 4项 | C. | 3项 | D. | 2项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4溶于水的部分能够电离,所以BaSO4是电解质 | |
| B. | SO2的水溶液能够导电,所以SO2是电解质 | |
| C. | 液态Cl2不导电,所以Cl2是非电解质 | |
| D. | 盐酸能导电,所以盐酸是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com