
【题目】向密闭容器中充入物质的量浓度均为![]() 的
的![]() 和
和![]() ,在一定条件下发生反应
,在一定条件下发生反应![]() ,测得
,测得![]() 的平衡转化率与温度及压强关系如图所示。下列说法不正确的是
的平衡转化率与温度及压强关系如图所示。下列说法不正确的是

A.平衡时CO与![]() 的物质的量比为1:1
的物质的量比为1:1
B.![]() 、
、![]() 、
、![]() 、
、![]() 由大到小的顺序为
由大到小的顺序为![]()
C.1100℃,![]() 条件下,该反应10min时达到平衡点X,则
条件下,该反应10min时达到平衡点X,则![]()
D.X点对应温度下,该反应的平衡常数为![]()
![]()
科目:高中化学 来源: 题型:
【题目】2019年9月,我国科研人员研制出Ti-H-Fe双温区催化剂,其中Ti-H区域和Fe区域的温度差可超过100℃。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法错误的是 ( )

A.①②③在高温区发生,④⑤在低温区发生
B.该历程中能量变化最大的是2.46eV,是氮分子中氮氮三键的断裂过程
C.在高温区加快了反应速率,低温区提高了氨的产率
D.使用Ti-H-Fe双温区催化合成氨,不会改变合成氨反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗结肠炎药物的有效成分(R)的结构简式如下。下列说法不正确的是
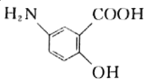
A. R能发生加成、取代反应
B. R分子中所有C和N原子一定共平面
C. R的苯环上官能团位置异构体有10种
D. R的分子式为C7H7O3N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的有( )
①苯的邻位二氯取代物只有一种
②甲烷的二氯取代产物有两种
③C3H8的二氯代物共有4种
④可用酸性高锰酸钾溶液除去乙烷中的乙烯
⑤分子式是C4H8的烃分子中一定含有碳碳双键
⑥将苯滴入溴水中,振荡后水层接近无色是因为苯与溴水发生了取代反应
⑦苯的同系物是分子中仅含有一个苯环的所有烃类物质
⑧菲的结构简式为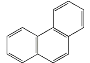 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
A. 2个B. 3个C. 4个D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,下列有机物分子中带“*”碳原子就是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的是

A. 与银氨溶液作用发生银镜反应B. 催化剂作用下与![]() 反应
反应
C. 与乙酸发生酯化反应D. 与NaOH溶液加热条件下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示,下列说法错误的是( )

A.配制400mL上述溶液可选用500mL容量瓶
B.该注射液中葡萄糖的物质的量浓度为0.01molL﹣1
C.该注射液为一种分散系,但不能产生丁达尔现象
D.可用新制氢氧化铜悬浊液检验人体尿液中是否含有葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常利用周期表中同族元素的相似性与递变性研究元素的原子结构和性质。回答下列问题:
(1)现代化学中,常利用_____特征谱线来鉴定元素。
(2)氧族元素中,氧、硫、硒三元素的第一电离能由大到小的顺序为_____(用元素符号回答),气态SO3为单分子状态,其分子空间构型为_____。若SO3的三聚体(SO3)3的环状结构如图所示,则该结构中S原子的杂化轨道类型为_____。
(3)卤族元素的氢化物中,H﹣F键的键能>H﹣Cl键的键能>H﹣Br键的键能,原因是_____。
(4)铁、钴、镍同处在元素周期表中_____族,它们的阳离子易形成各种配合物,已知:磁矩u=![]() ,n为中心原子或离子的单电子数,实验测得配合物[Co(NH3)4Cl2]Cl中u=0,则其中心粒子的化合价为_____,其价电子排布图为_____。
,n为中心原子或离子的单电子数,实验测得配合物[Co(NH3)4Cl2]Cl中u=0,则其中心粒子的化合价为_____,其价电子排布图为_____。
(5)已知:铜晶体为面心立方最密堆积,铜原子半径为rpm,阿伏加德罗常数用NA表示,则铜晶体密度的计算式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中 使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀。
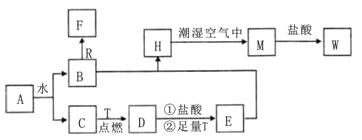
(1)物质A的化学式为 ________,F化学式为 ________;
(2)B和R在溶液中反应生成F的离子方程式为__________________________;
(3)H在潮湿空气中变成M的实验现象是________,化学方程式为______________;
(4)A和水反应生成B和C的化学方程式为__________________________
(5)印刷行业刻制印刷电路板(含有铜箔)时,要用W溶液中作为“腐蚀液”,写出该反应的离子方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com