
下列实验方案设计中,可行的是( )
A.加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B.用萃取的方法分离汽油和煤油
C.用溶解、过滤的方法分离硝酸钾和氯化钠固体的混合物
D.将氢气和氧气的混合气体通过灼热的氧化铜,以除去其中的氢气
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:填空题
(6分)欲分离苯和苯酚,一般可向其混合物中加入稍过量的浓氢氧化钠溶液,反应的离子方程式为 。再将该混合物转移到分液漏斗中,振荡,静置后溶液将出现 现象,然后分液。从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是 ;向另一份溶液中加入浓溴水,发生反应的化学方程式是 。从分液漏斗上口倒出的上层液体是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省淄博市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
(12分)【化学——化学与技术】
合成氨工业对国民经济和社会发展具有重要意义,下图是工业合成氨的简要流程示意图。

(1)合成氨的原料气往往混有CO2等杂质,在进入合成塔之前需净化,其原因是_______ 。
(2)工业上合成氨选择的适宜条件是:以铁为主的催化剂、_______、________。
(3)沿X路线进入合成塔的物质是_______,这样设计的意义是________。
(4)目前工业制硝酸所采用的主要方法是_______法。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省淄博市高三二模理综化学试卷(解析版) 题型:选择题
25℃时,向20.00mLNaOH溶液中逐滴加入0.20mo1·L-l的CH3COOH溶液得到如图曲线。下列说法正确的是
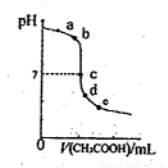
A.水电离出的氢离子浓度:a>b
B.c点时恰好中和
C.在d~e之间存在如下关系:C(Na十)>c(CH3COO-)>c(H十)>c(OH一)
D.e点时溶液中溶质是CH3COONa和CH3COOH
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省淄博市高一下学期期末考试化学试卷(解析版) 题型:实验题
(18分)NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
_____________________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁 B.铝 C.铂 D.玻璃
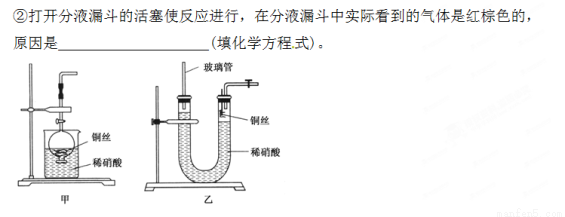
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反就开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是___________________________________。
②让反应停止的操作方法及原因是________________________。
(4)以下收集NO气体的装置,合理的是________(填选项代号)。

(5)假设实验中12.8 g Cu全部溶解,需要通入标况下________mL O2才能使NO全部溶于水。
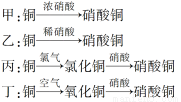
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”),理由是___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高一5月质量检测化学试卷(解析版) 题型:填空题
(11分)A、B、C、D四种短周期元素。原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写出下列元素的名称:A_______,B ,C_______,D 。
(2)D的质子数和中子数相等,D的原子组成符号为 ,它的最高价为___________价。
(3)用电子式表示A、D两元素形成AD2的过程: ;
写出C2B2的电子式 。
(4)氢元素与B、D 均可以形成原子个数比为2:1的化合物,H2B的熔沸点高于H2D的原因是
。
(5)写出甲和A的最高价氧化物反应的化学方式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高一5月质量检测化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市3月质量检测高一化学试卷(解析版) 题型:选择题
下列各组元素中,原子半径依次增大的是:( )
A. I、Br、ClB. Al、Si、PC. O、S、NaD. C、N、B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com