
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、c(NH3?H2O)>c(OH-)>c(NH4+)>c(H+) |
| B、c(NH4+)>c(NH3?H2O)>c(OH-)>c(H+) |
| C、c(NH3?H2O)>c(NH4+)=c(OH-)>c(H+) |
| D、c(NH3?H2O)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸的体积增大 |
| B、用小刀切割金属钠时,发现切面由银白色变暗 |
| C、澄清的石灰水变浑浊 |
| D、氢氧化钠的表面发生潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:SiI4<SiBr4<SiCl4<SiF4 |
| B、沸点:H2S>H2O>HF>NH3 |
| C、熔点:金刚石>晶体硅>晶体锗>硫 |
| D、硬度:金刚石>白磷>冰>水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )| A、电极A表面反应之一为NO2-e-+H2O═NO3-+2H+ |
| B、电极B附近的c(NO3-)增大 |
| C、电解质溶液中电流的方向由B到A,电子的流向与之相反 |
| D、该电池工作时,每转移4 mol电子,生成22.4LO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
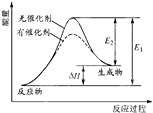 某反应的反应过程中能量的变化如图所示,图中E1表示正反应的活化能,E2表示逆反应的活化能,下列有关叙述正确的是( )
某反应的反应过程中能量的变化如图所示,图中E1表示正反应的活化能,E2表示逆反应的活化能,下列有关叙述正确的是( )| A、该反应为放热反应 |
| B、催化剂能改变该反应的焓变 |
| C、E1也可表示反应物断键需要吸收的总能量 |
| D、△H=E2-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 标准状况,体积相同的四支试管中分别盛满Cl2、NH3、SO2和NO2,分别倒立在盛有足量水的水槽中(假设进入试管的液体不扩散),光照充分溶解.
标准状况,体积相同的四支试管中分别盛满Cl2、NH3、SO2和NO2,分别倒立在盛有足量水的水槽中(假设进入试管的液体不扩散),光照充分溶解.查看答案和解析>>
科目:高中化学 来源: 题型:
 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com