
| A. | 85L | B. | 75L | C. | 73L | D. | 70L |
分析 先写出燃烧的方程式,根据体质数据可知氧气过量,然后利用差量法分别计算出丙烷和乙烷完全燃烧后气体减少的总体积,然后计算出反应后的气体总体积即可.
解答 解:80L空气中约含有氧气的体积为:80L×$\frac{1}{5}$=16L,则氧气过量,
2C2H6+7O2$\stackrel{点燃}{→}$4CO2+6H2O△V
2 7 4 5
2L 10L
C3H8+5O2$\stackrel{点燃}{→}$3CO2+4H2O△V
1 5 3 3
1L 3L,
则1L丙烷和2L乙烷完全燃烧后气体总体积减少:10L+3L=13L,
所以反应后气体总体积为:80L+1L+2L-13L=70L,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握差量法在化学计算中的应用方法,试题侧重考查学生的分析能力及化学计算能力.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | 用10%的盐酸蒸发浓缩获得30%的盐酸 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 二氧化硫具有漂白性,与氯水混合使用效果更好 | |
| D. | 可利用丁达尔效应来区别淀粉溶液和氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Na+、Cl-、CO32- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | H+、Al3+、NH4+、SO42- | D. | Na+、Cl-、Ca2+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔沸点:H2O>HF>HCl | B. | 原子半径:Mg>Na>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 热稳定性:H2O>HF>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH2+CHCOOH$\stackrel{△}{?}$
NH2+CHCOOH$\stackrel{△}{?}$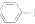
 +H2O
+H2O| 名称 | 相对分子质量 | 性状 | 密度/(g/cm3) | 熔点/℃ | 沸点/℃ | 溶解度 | |
| 苯胺 | 93 | 无色油状液体具有还原性 | 1.02 | -6.1 | 184 | 微溶于水 | 均易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 16.5 | 118 | 易溶于水 | |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 114 | 304 | 微溶于冷水,溶于热水 | |
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳 | Fe | Mg | Al | Cr |
| 开始沉淀时的H | 1.9 | 9.0 | -- | -- |
| 沉淀完全时的H | 3. | 11.1 | 8 | 9 (>9溶解) |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )
粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )| A. | 甲池中电解质溶液的pH值减小 | |
| B. | 乙池中CuSO4溶液的浓度不变 | |
| C. | 甲池中理论上消耗空气的体积是2.8L(空气中O2体积分数以20%计算) | |
| D. | 甲池通入CH3OH一极的电极反应为:CH3OH-6e-+2H2O═CO32-+8H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 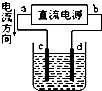 装置中,d为阳极、c为阴极 | |
| B. | 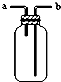 装置由a进气可用于收集H2、NH3、CO2、Cl2 等气体 | |
| C. |  装置中X若为CCl4,可用于吸收NH3 或HCl,并可防止倒吸 | |
| D. | 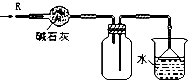 装置可用于干燥、收集HCl,并吸收多余的HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com