
| 选项 | 说法1 | 说法2 | 判断 |
| A | Na+、Mg2+、O2-、F-中离子半径最大的是O2- | I的原子半径大于Br,HI比HBr的热稳定性强 | 说法1说法2均正确 |
| B | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | 热稳定性:HCl>HI | 说法1说法2均正确 |
| C | 原子半径:Na>Mg | 酸性:H2SO3>H2SO4 | 说法1说法2均错误 |
| D | 同主族元素的简单阴离子还原性越强,水解程度越大 | 同周期金属元素的化合价越高,其原子失电子能力越强 | 说法1错误说法2正确 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.电子层结构相同的离子,离子半径随着原子序数增大而减小;同一主族元素,原子半径随着原子序数增大而增大,元素非金属性越强,其氢化物的稳定性越强;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;元素的非金属性越强,其氢化物的稳定性越强;
C.同一周期元素,原子半径随着原子序数增大而减小;同一种非金属元素的含氧酸,含有非羟基O原子个数越多,其酸性越强;
D.同一主族元素的简单阴离子,其还原性越强,该离子不一定水解;同一周期金属元素,其化合价越高,其金属性越弱.
解答 解:A.电子层结构相同的离子,离子半径随着原子序数增大而减小,Na+、Mg2+、O2-、F-中离子半径最大的是O2-,该说法正确;同一主族元素,原子半径随着原子序数增大而增大,元素非金属性越强,其氢化物的稳定性越强,原子半径I>Br,非金属性Br>I,则氢化物的稳定性HBr>HI,该说法错误,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性P>Si,所以H3PO4比H2SiO3的酸性强,所以该说法正确;元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>I,则氢化物的稳定性HCl>HI,该说法正确,故B正确;
C.同一周期元素,原子半径随着原子序数增大而减小,原子半径Na>Mg,该说法正确;同一种非金属元素的含氧酸,含有非羟基O原子个数越多,其酸性越强,亚硫酸中非羟基氧原子个数是1、硫酸中非羟基O原子个数是2,所以酸性:H2SO3<H2SO4,该说法错误,故C错误;
D.同一主族元素的简单阴离子,其还原性越强,该离子不一定水解,如碘离子还原性比氟离子强,但碘离子不水解、氟离子水解,该说法错误;同一周期金属元素,其化合价越高,其金属性越弱,原子失电子能力越弱,该说法错误,故D错误;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断及对元素周期律的灵活运用,明确原子结构、元素周期律是解本题关键,知道规律中的异常现象,易错选项是D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
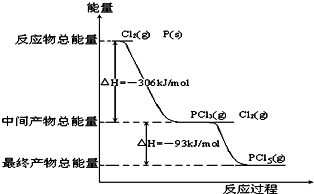
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{16a}{3}$ | B. | a | C. | 32a | D. | $\frac{a}{32}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外小组欲鉴定某硫酸钠样品中是否含有亚硫酸钠,设计方案如下:取少量固体配成溶液,往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色.如果溶液紫色褪去,说明该样品中含有亚硫酸钠.
某课外小组欲鉴定某硫酸钠样品中是否含有亚硫酸钠,设计方案如下:取少量固体配成溶液,往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色.如果溶液紫色褪去,说明该样品中含有亚硫酸钠.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| v正 | v逆 | 平衡常数K | 转化率α |
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
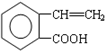
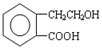 ,它可通过不同化学反应分别制得B、C和D 三种物质.
,它可通过不同化学反应分别制得B、C和D 三种物质.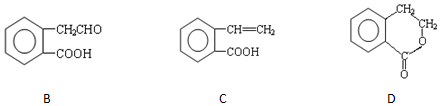
 +H2O
+H2O
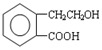 .
.

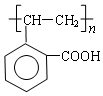 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com