
【题目】碳、磷、硫等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是____(填字母)。
A. ![]()
B. ![]()
C. ![]()
D. ![]()
(2)P4S3可用于制造火柴,其分子结构如图所示:
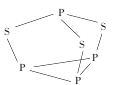
①P4S3分子中硫原子的杂化轨道类型为____。
②每个P4S3分子中含有的孤电子对的数目为____对。
(3)科学家合成了一种阳离子“N5n+”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键,此后又合成了一种含有“N5n+”的化学式为“N8”的离子晶体(该晶体中每个N原子都达到了8电子稳定结构),N8的电子式为____。(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为____。
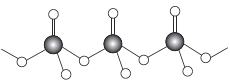
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为____。
(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是 ___。
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
金属阳离子半径/pm | 66 | 99 | 112 | 135 |
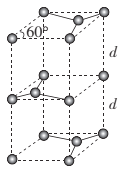
(6)石墨的晶胞结构如图所示。已知石墨的密度为ρg.cm-3,C-C键的键长为r cm,M为阿伏加德罗常数的值,则石墨晶体的层间距d= ___cm。
【答案】A<C<B<D sp3 10 ![]() N≡C-C≡N
N≡C-C≡N ![]() 碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越难分解,热分解温度越高
碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越难分解,热分解温度越高 ![]()
【解析】
(1)轨道中电子能量:1s<2s<2p,能量较高的轨道中电子越多,该微粒能量越高,所以2p轨道上电子越多、1s轨道上电子越少,该微粒能量越高,根据图知能量由低到高的顺序是A<C<B<D;
(2)①该分子中每个S原子形成2个共价键且还含有2个孤电子对,根据价层电子对互斥理论可知S原子杂化类型为sp3;
②该分子中每个S原子含有2个孤电子对、每个P原子含有1个孤电子对,所以该分子中孤电子对个数=3×2+4×1=10;
(3)N5n+结构是对称的,5个N排成V形,5个N结合后都达到8电子结构,且含有2个N≡N键,满足条件的结构为: ,故“N5”带一个单位正电荷,所以化学式为”N8”的阴离子为N3-、阳离子为
,故“N5”带一个单位正电荷,所以化学式为”N8”的阴离子为N3-、阳离子为 ,N8的电子式为
,N8的电子式为![]() ;分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满是8电子稳定结构,则每个C原子形成4个共价键、每个N原子形成3个共价键,其结构简式为N≡C-C≡N;
;分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满是8电子稳定结构,则每个C原子形成4个共价键、每个N原子形成3个共价键,其结构简式为N≡C-C≡N;
(4)含有n个P原子的多聚磷酸根离子,相当于是n个磷酸根离子中去掉了(n-1)氧原子,O原子数目=4n-(n-1)=3n+1,所带电荷为(-2)×(3n+1)+5n=-(n+2),故多聚磷酸根离子的通式为:![]() ;
;
(5)碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越难分解,热分解温度越高;
(6)晶胞中C原子的数目为![]() ,所以晶胞质量为
,所以晶胞质量为![]() ;设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为
;设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为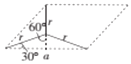 ,则
,则![]() ,所以a=
,所以a=![]() r,则底面面积为
r,则底面面积为![]() cm2,则晶胞体积为V=
cm2,则晶胞体积为V=![]() cm3,所以有
cm3,所以有 ,解得d=
,解得d=![]() 。
。


科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是(已知酮基只与氢气加成,与Br2不反应)( )
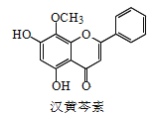
A.汉黄芩素的分子式为C16H13O5
B.该物质遇FeCl3溶液显色
C.1mol该物质与溴水反应,最多消耗1molBr2
D.与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
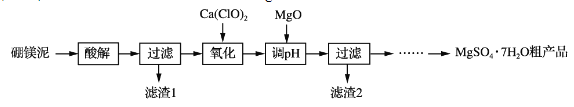
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时为提高Mg2+的浸出率,可采用的措施是_____(写一种)。所加酸不宜过量太多的原因是_____。
(2)“氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为______________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________________________。
(3)“调pH”时用MgO而不用NaOH溶液的原因是________________________。
(4)结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,_________________________________________________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)附:两种盐的溶解度(g/100 g水)
温度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包裹在冰晶之间,形成“盐泡”,其大致结构如图所示,若海冰的冰龄达到1年以上,则融化后的水为淡水。下列叙述正确的是
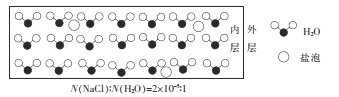
A.海冰内层“盐泡”越少,密度越大
B.海冰冰龄越短,内层的“盐泡”越少
C.每含1mol H2O的海冰内就有2×l0-5 NA个NaCl分子(NA为阿伏加德罗常数)
D.海冰内层NaCl的浓度约为l0-3 mol/L(设冰的密度为0.9 g.cm-3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物 A,由 C、H、O三种元素组成,在一定条件下,由 A可以转化为有机物 B、C 和 D、E;C又可以转化为 B、A。它们的转化关系如下:
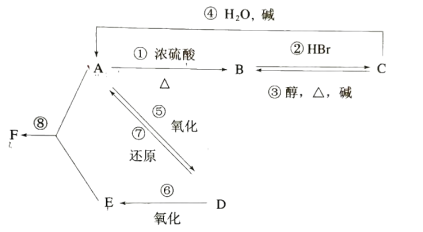
已知 D 的蒸气密度是氢气的 22 倍,并可以发生银镜反应。回答下列问题:
(1)D 的分子式是______________________
(2)F 的名称是_________________________
(3)在①②③④等反应中,属于消去反应的是________________________。
(4)在 A、B、C、D、E、F 中,能与酸性高锰酸钾溶液反应的是(填字母)________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4HCO3的分解温度是 35℃。以氯化钾和制取二氧化钛的副产品硫酸亚铁为原料生产铁红颜料和过二硫酸铵等,原料的综合利用率较高。其主要流程如下:
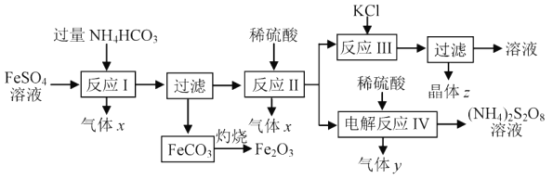
(1)气体x是_________,反应 I 需控制反应温度低于35℃ , 其目的是_______。
(2)反应I的离子方程式为 ___________,FeCO3灼烧的反应方程式为 __________。
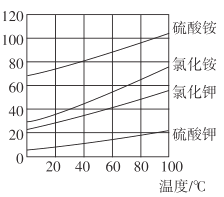
(3)各物质的溶解度曲线如图,晶体z是____,简述反应III发生的原因 ________,工业生产上常在反应III的过程中加入一定量的乙醇,其目的是_____________。
(4)反应IV 常用于生产(NH4)2S2O8 (过二硫酸铵)。电解时均用惰性电极,气体y是__________,阳极发生的电极反应可表示为_______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数为NA。关于 l00mLl mol/L的Fe2(SO4)3溶液,下列说法正确是
A.加NaOH可制得Fe(OH)3 胶粒0.2NA
B.溶液中阳离子数目为0.2NA
C.加Na2CO3 溶液发生的反应为 3CO32-+ 2Fe3+ = Fe2(CO3 )3↓
D.Fe2(SO4)3溶液可用于净化水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是( )
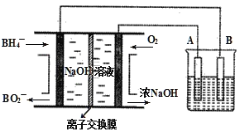
A.离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B.该燃料电池的负极反应式为BH4+8OH--8e-=BO2-+6H2O
C.电解池中的电解质溶液可以选择CuCl2溶液
D.每消耗2.24LO2(标准状况)时,A电极的质量减轻12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.使甲基橙试液变红的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
B.常温下,![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
C.溶质为![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
D.水电离出的![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com