
【题目】在一条鱼、虾绝迹的小河边有四座工厂甲、乙、丙、丁(如下图),它们排出的废液里,每个工厂只有Na2CO3、CuCl2、Ca(OH)2、HCl中的一种。某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈浅蓝色浑浊;③丙处河水由浑变清;④丁处产生气泡,河水仍清,请推断:

(1)四座工厂排除的废液里含有的污染物:甲____,乙_____,丙____,丁______。
(2)在M处取出的河水中,肯定含有的离子是______。
(3)写出有关离子方程式___________。
【答案】Ca(OH)2、CuCl2、HCl、Na2CO3 Ca2+、Cu2+、Cl-、H+ Ca(OH)2+Cu2+=Ca2++Cu(OH)2↓ Cu(OH)2+2H+=Cu2++2H2O Ca(OH)2+2H+=Ca2++2H2O CO32-+2H+=CO2↑+H2O
【解析】
(1)、由甲处河水呈乳白色,可知在甲处应含有Ca(OH)2;乙处河水呈浅蓝色浑浊,可知乙在甲处的下方且乙排放出的是CuCl2;丙处河水由浑变清,可得丙处在甲乙的下方且丙处排放出的是HCl;丁处产生气泡,河水仍清,说明丁在丙的下方且含有碳酸钠,根据上面的推断,四座工厂排出的废液里含有的污染物依次是Ca(OH)2、CuCl2、HCl、Na2CO3。
(2)、M在工厂的下方,所以M处的河水中肯定含有的离子有:Ca2+、Cu2+、Cl-、H+。
(3)、在乙处发生的是Ca(OH)2和CuCl2的反应,因甲处河水呈乳白色,说明Ca(OH)2未完全溶解,Ca(OH)2应写成化学式,所以反应的离子方程式是:Ca(OH)2+Cu2+=Ca2++Cu(OH)2↓;丙处河水变清,说明是Ca(OH)2和Cu(OH)2与HCl的反应,反应的离子方程式是:Cu(OH)2+2H+=Cu2++2H2O、Ca(OH)2+2H+=Ca2++2H2O;丁处产生气泡,且河水仍清,故发生的是Na2CO3和HCl的反应,反应的离子方程式是:CO32-+2H+=CO2↑+H2O。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 甲苯可以与液溴混合后加入铁粉生成![]()
B. 实验室制备乙烯时,温度计水银球应该插入浓硫酸和无水乙醇的混合液液面以下
C. 向溴乙烷中加入NaOH溶液加热,充分反应,再加入AgNO3溶液,产生淡黄色沉淀,证明溴乙烷中含有溴元素
D. 制备新制Cu(OH)2悬浊液时,将4~6滴2%的NaOH溶液滴入2mL2%的CuSO4溶液中,边滴边振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa,常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示,下列说法正确的是
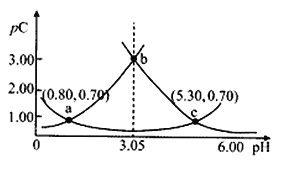
A. 随着pH的增大,pC增大的曲线是A2-的物质的量浓度的负对数
B. pH=3. 50 时, c(HA-)>c(A2-)>c(H2A)
C. b点时c(H2A).c(A2-)/c2(HA-)=104.5
D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】放热反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)在温度t1时达到平衡,平衡时C1(CO)=C1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为C2(CO)和C2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,平衡时C1(CO)=C1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为C2(CO)和C2(H2O),平衡常数为K2,则
A. K1和K2的单位均为mol/L B. K1 < K2
C. C2(CO) = C2(H2O) D. C1(CO) > C2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:除去CO的化学反应方程式为:[Cu(NH3)]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题
(1)基态Fe原子的核外电子排布式为______________________;
(2)铁的一种配合物Fe(CO)x的中心原子价电子数与配体用于成键提供的电子数之和为18,则x=__________;已知该配合物的熔点为-20.5℃,沸点为103℃,易溶于CC14,据此可以判断Fe(CO)x晶体属于___________(填晶体类型)。与CO互为等电子体的分子的分子式为___________。
(3)配合物[Cu(NH3)]OOCCH3中碳原子的杂化类型是___________。用[Cu(NH3)]OOCCH3除去CO的反应中,肯定有___________形成。
a.离子键 b.配位键 c.非极性键 d.σ键
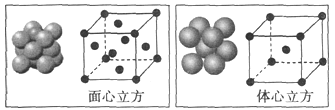
(4)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为___________。铁晶体的体心立方堆积空间利用率为___________(用含π的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是

A. OH+HCl=H2O+ClB. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+Cu2+=Cu+Fe2+D. Fe+2H+=Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。


(1)仪器D的名称是________。安装F中导管时,应选用图2中的________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是_____________________________________________________________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为________________________________________________________________________。
在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是
________________________________________________________________________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是________________,原因是________________________________________________________________________。

图3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同。已知:2NO2(g)![]() N2O4(g)△H<0。
N2O4(g)△H<0。
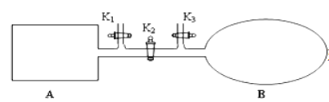
(1) 一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A)______________v(B) (填“<”、“>”或“=”);若打开活塞K2,气球B将______________(填“变大”、“变小”或“不变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将______________ 。若通入等量的Ne气,则达到平衡时,A中NO2的转化率将______________,B中NO2的转化率将______________。
(3)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com