
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有澄清石灰水、 | 若 若 若 |
| 实验操作 | 预期现象与结论 |
| 8.0 mol?L-1 NaOH溶液 并将带火星的木条放在最后一个的洗气瓶的出口处. | 澄清石灰水不变浑浊,木条复燃; 澄清石灰水变浑浊,木条不复燃; 澄清石灰水变浑浊,木条复燃. |


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
 CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、最高价氧化物对应水化物的酸性:Q<W |
| B、最简单气态氢化物的热稳定性:R>Q |
| C、含T的盐中,T元素只能存在于阳离子中 |
| D、原子半径:T>Q>R |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2O) |
| n(CO) |
| | =1 | =3 | =5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
| n(H2O) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
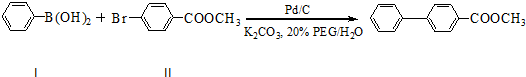

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡状态时,若c(CO)=0.100 mol?L-1,则c(CO2)=0.0263 mol?L-1 |
| B、若要提高CO的转化率,则应该加入适当的过量FeO |
| C、升高温度混合气体的平均相对分子质量不变 |
| D、若生成56gFe,则吸收的热量小于a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
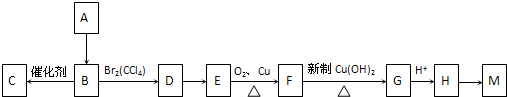
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com