
【题目】在不同条件下,分别测得反应2SO2+O2![]() 2SO3的化学反应速率,其中表示该反应进行得最快的是( )
2SO3的化学反应速率,其中表示该反应进行得最快的是( )
A.v(SO2)=4 mol·L-1·min-1B.v(O2)=3 mol·L-1·min-1
C.v(SO2)=0.1 mol·L-1·s-1D.v(O2)=0.1 mol·L-1·s-1
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列关于该有机物的说法正确的是
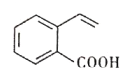
A. 1mol 该有机物最多与4molH2反应生成C9H16O2
B. 该有机物中所有碳原子不可能处于同一平面上
C. 该有机物能发生酯化、加成、氧化、水解等反应
D. 与该有机物具有相同官能团的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 mol/L的NH4Br溶液中通人适量氨气呈中性,此时溶液中NH4+的数目为NA
B.25 °C时,Ksp (BaCO3)=2.5×10-9 ,则BaCO3饱和溶液中Ba2+ 的浓度为5×10-5 mol/L
C.100g 17%双氧水中含有H原子的数目为NA
D.28g N2和CO的混合气体中含有的氧原子的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种常用的化工原料,可应用于化学和食品加工过程的惰性保护、焊接气体、植物生长刺激剂,在铸造中用于硬化模和芯子及用于气动器件,还应用于杀菌气的稀释剂。请回答下列问题:
I.我国中科院研究所利用CO2与环氧丙烷( )合成生物降解聚碳酸酯(PPC)和聚(碳酸酯-醚)多元醇,则环氧丙烷中碳元素的平均化合价为____,CO2 的结构式为_________。
)合成生物降解聚碳酸酯(PPC)和聚(碳酸酯-醚)多元醇,则环氧丙烷中碳元素的平均化合价为____,CO2 的结构式为_________。
II.CO2 与H2反应可用于生产甲醇
(1)已知氢气与甲醇的燃烧热分别为a kJ·mol-1、b kJ·mol-1 , H2O(g)= H2O(l) △H=c kJ·mol-1 ,CH3OH(g)=CH3OH(l) H=d kJ·mol-1,则CO2与H2反应产生气态甲醇与气态水的热化学方程式为__________________________。
(2)取一定体积的CO2和H2的混合气体,加入恒容密闭容器中,发生上述反应,相同时间内,测得甲醇的体积分数![]() (CH3OH)与反应温度T的关系如图1所示,则该反应的
(CH3OH)与反应温度T的关系如图1所示,则该反应的![]() (CH3OH)随反应温度T变化的原因为_______________。
(CH3OH)随反应温度T变化的原因为_______________。
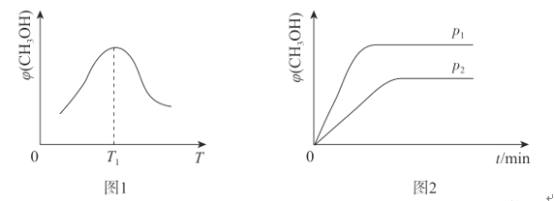
(3)温度为T时,向体积分别为V1、V2的甲.乙两容器中充人相同量的CO2和H2的混合气体,经过一段时间两容器均达到平衡,测得压强分别为p1、p2,如图2所示,则p1_____(填“>”“<”或“=”)p2。
(4)一定温度下,在1 L的密闭容器中,充入1 mol CO2和3 mol H2,压强为p0 kPa,发生上述反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
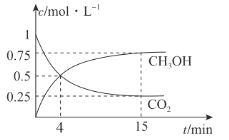
①反应进行到4 min 时,v(正)________ (填“>”“<"或“=”)v(逆)。0~4 min,H2 的平均反应速率v(H2)=______ mol· L-1·min- 1。
②CO2平衡时的体积分数为____________,该温度下Kp=________ (可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )

A. KO2中只存在离子键
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. 晶体中与每个K+距离最近的O2-有6个
D. 晶体中,所有原子之间都以离子键相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是高熔点金属,工业上用主要成分为FeWO4和MnWO4的黑钨铁矿与纯碱共熔冶炼钨的流程如下,下列说法不正确的是( )

A.将黑钨铁矿粉碎的目的是增大反应的速率
B.共熔过程中空气的作用是氧化Fe(II)和Mn(II)
C.操作II是过滤、洗涤、干燥,H2WO4难溶于水且不稳定
D.在高温下WO3被氧化成W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Fe2+的最外层电子排布式__;基态铜原子的电子排布式为__。
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2-配离子,则钛元素的化合价是__,配体是__。
(3)TiCl3可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2![]()
![]() ,该反应中涉及的物质中碳原子的杂化轨道类型有__;反应中涉及的元素中电负性最大的是__。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__。
,该反应中涉及的物质中碳原子的杂化轨道类型有__;反应中涉及的元素中电负性最大的是__。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__。
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为__,在SiC中,每个C原子周围最近的C原子数目为__,若晶胞的边长为apm,则金刚砂的密度为__。
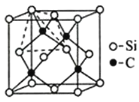
查看答案和解析>>
科目:高中化学 来源: 题型:
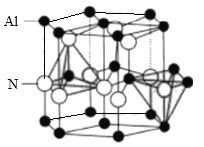
【题目】氮化铝(AlN)陶瓷是一种新型无机非金属材料, 最高可稳定到2473K, 导热性好、热膨胀系数小,是良好的耐热冲击材料。制取原理为:Al2O3+3C+N2![]() 2A1N+3CO,回答下列问题:
2A1N+3CO,回答下列问题:
(1)氮化铝的晶体类型为________。在上述化学方程式中第二周期元素的第一电离能由小到大的顺序是______。
(2)基态氧原子电子占据最高能级的原子轨道的形状是________,未成对电子数为________。
(3)等电子体具有相似的结构。CO与N2互为等电子体,CO分子中σ键与π键数目之比为_______。
(4)Cu2+处于:[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,则Cu2+是否为sp3杂化________(填“是”或“否”)理由为_________。
(5)AlN晶体结构如图所示,1个Al原子周围距离最近的Al原子数为______个;若晶胞结构的高为a nm, 底边长为b nm,NA表示阿伏伽德罗常数的值,则其密度为_______g.cm-3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com