
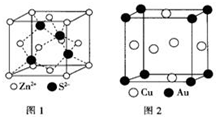
 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8 等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8 等.回答下列问题:分析 (1)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写核外电子排布式;
(2)异硫氰酸分子间可形成氢键,根据氢键对沸点的影响分析;
(3)K3[Fe(CN)6]晶体中,K+与[Fe(CN)6]3-形成离子键,CN-中C、N原子间形成共价键,Fe3+与CN-形成配位键;
(4)金属锌晶胞为六方最密堆积,根据晶胞的结构图可求S2-的配位数;
(5)根据均摊法计算出晶胞中Cu、Au原子数,根据ρ=$\frac{m}{V}$计算密度;
(6)Cu与O2、浓氨水溶液反应生成铜氨络离子.
解答 解:(1)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)由于异硫氰酸分子间可形成氢键而硫氰酸分子间不能形成氢键,存在分子间氢键时沸点较高,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸,
故答案为:异硫氰酸分子间可以形成氢键,而硫氰酸分子间不能;
(3)K3[Fe(CN)6]晶体中,K+与[Fe(CN)6]3-形成离子键,CN-中C、N原子间形成共价键,Fe3+与CN-形成配位键,即微粒间的作用力有离子键、共价键和配位键,不涉及的作用力有氢键、金属键和分子间的作用力,
故答案为:def.
(4)根据图1可知,金属锌晶胞为六方最密堆积,距离S2-最近的锌离子有4个,即S2-的配位数为4,
故答案为:六方最密堆积;4;
(5)Cu原子位于晶胞面心,数目为6×$\frac{1}{2}$=3,Au原子为晶胞顶点,数目为8×$\frac{1}{8}$=1,晶胞体积V=a3cm3,
密度ρ=$\frac{m}{V}$=$\frac{\frac{64×3+197}{{N}_{A}}}{{a}^{3}}$=$\frac{389}{{a}^{3}•{N}_{A}}$g•cm-3,
故答案为:$\frac{389}{{a}^{3}•{N}_{A}}$.
(6)将Cu单质的粉末加入浓氨水溶液中,并通入O2,Cu与O2、浓氨水溶液反应生成铜氨络离子,其反应的离子方程式为:2Cu+8NH3.H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;
故答案为:2Cu+8NH3.H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O.
点评 本题考查了晶体结构、核外电子排布、配合物以及晶胞的计算等知识,重在考查学习获知题给信息的能力和解决问题的能力,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
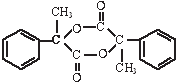 )是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图:
)是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图: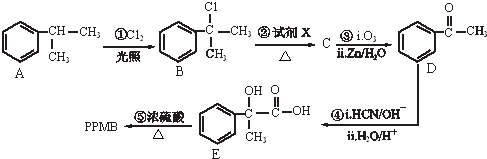
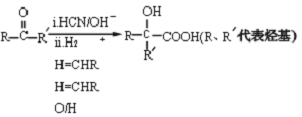
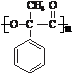 .
. +2NaOH$\stackrel{△}{→}$2
+2NaOH$\stackrel{△}{→}$2 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
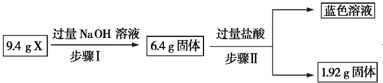
| A. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 为减小酸碱中和滴定的实验误差,锥形瓶必须洗净、烘干后使用 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 | |
| D. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,可知100 mL 0.1 mol•L-1 的盐酸与100 mL 0.1 mol•L-1 的氨水混合,放出的热量等于0.573 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
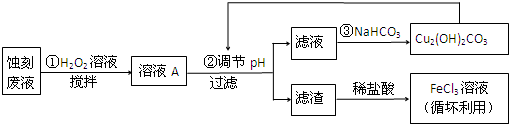
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
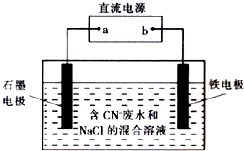 工业上,在强碱性条件下用电解法除去废水中的CN-,装置如右图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装置如右图所示,依次发生的反应有:| A. | 除去1 mol CN-,外电路至少需转移5 mol电子 | |
| B. | 通电过程中溶液的pH不断增大 | |
| C. | 为了使电解池连续工作,需要不断补充NaCl | |
| D. | 铁电极上发生的反应为Fe一2e一═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法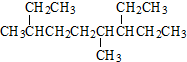 的名称为:4,7-二甲基-3-乙基辛烷 的名称为:4,7-二甲基-3-乙基辛烷 | |
| B. | 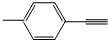 分子中所有原子共平面 分子中所有原子共平面 | |
| C. | 肌醇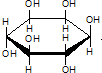 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 | |
| D. | 1.0 mol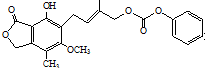 最多能与含5 mol NaOH的水溶液完全反应 最多能与含5 mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3=2Al+3+3SO4-2 | B. | K2SO4=2K++S6++4O2- | ||
| C. | CuCl2=Cu2++2Cl- | D. | Na2CO3=Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
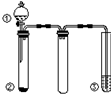 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
| B | 稀硝酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 浓盐酸 | MnO2 | NaOH溶液 | 氧化性:MnO2>Cl2 |
| D | 浓硫酸 | 蔗糖 | 酸性KMnO4溶液 | 浓硫酸具有酸性、脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com