
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| B. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| C. | 以淀粉为原料可制取乙酸乙酯 | |
| D. | 食用花生油和鸡蛋清都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种工艺均需采用加热和冷却装置 | |
| B. | 实验室中进行这三种操作时均需在烧瓶中进行 | |
| C. | 三种工艺均是物理变化过程 | |
| D. | 三种工艺均是化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);
(1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
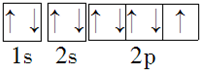
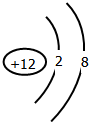
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油能使溴的四氯化碳溶液褪色 | |
| B. | 蛋白质、纤维素、油脂、淀粉都是高分子化合物 | |
| C. | 石油裂化、煤的干馏、铝热反应都属于化学变化 | |
| D. | 乙烯常用作水果催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂和蛋白质都属于高分子化合物 | |
| B. | 乙醇室温下在水中的溶解度大于溴乙烷 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | “地沟油”禁止食用,但可以用来制皂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com