
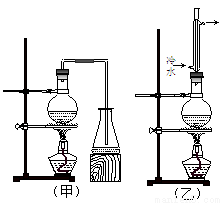
ʵ������ȡ���ᶡ����ʵ��װ��������ͼ��ʾ����װ�ù�ѡ�á����й����ʵ������������±���
| ���� | 1-���� | ���ᶡ�� |
�۵�(��) | 16.6 | ��89.5 | ��73.5 |
�е�(��) | 117.9 | 117 | 126.3 |
�ܶ�(g/cm3) | 1.05 | 0.81 | 0.88 |
ˮ���� | ���� | ����(9g/100gˮ) | �� |
��1����ȡ���ᶡ����װ��Ӧѡ�� (��ס����ҡ�)����ѡ��һ��װ�õ������� ��
��2����ʵ���������г������������ᶡ���⣬���������ɵ��л��������У�д���ṹ��ʽ���� �� ��
��3��������Ӧ��һ�����淴Ӧ��Ϊ���1-�����������ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
��4�����Ʊ����ᶡ�����õĻ�����з��롢�ᴿ���ᶡ��ʱ����Ҫ�����ಽ����������ͼʾ�IJ����У��϶���Ҫ�Ļ�ѧ������ ��ѡ��𰸱�ţ���
��5���л���ķ�������У�������Ҫʹ�÷�Һ©����������ʹ�÷�Һ©��ǰ���� ��ijͬѧ�ڽ��з�Һ����ʱ��������Һ�����������������ԭ�����Һ©�����������⣬������ ��
��1����6�֣��ң�2�֣� ���ڷ�Ӧ������1-�������ķе���ڲ������ᶡ���ķе�
��1�֣��������ü�װ�û���ɷ�Ӧ��Ĵ����ӷ������˷�Ӧ���ת���ʣ�1�֣�����װ����
��������������Ӧ�1�֣�������˷�Ӧ���ת���ʣ�1�֣���
��2����4�֣�CH3CH2CH2CH2OCH2CH2CH2CH3��2�֣� CH3CH2CH��CH2��2�֣�
��3����2�֣���������Ũ��
��4����2�֣�AC��ѡ1������ȷ1�֣���һ����1�֣������ָ��֣�
��5����2�֣�����Ƿ�©ˮ�������1�֣� ��Һ©���Ͽڲ������ϵİ���δ��©����
�ϵ�С������©���ڲ�δ����������ͨ��������δ��1�֣���
��������
�����������1��������Ŀ�����������ݣ�����Ͷ����ķе�������ᶡ���ķе㣬����װ���ң������ü�װ�û���ɷ�Ӧ��Ĵ����ӷ������˷�Ӧ���ת���ʣ���װ�ú�����������װ�ã���������������Ӧ�����˷�Ӧ���ת���ʣ�����ѡ����װ�á�
��2����Ϊ1-������Ũ���ᡢ���������¿��Է�����ȥ��Ӧ�ͷ��Ӽ���ˮ��Ӧ�����Կ������ɵ��л��������У�CH3CH2CH��CH2��CH3CH2CH2CH2OCH2CH2CH2CH3
��3����������Ũ�ȣ�ʹƽ��������Ӧ�����ƶ��������1-�����������ʡ�
��4����Ӧ��Ļ�����У������ܺ�ˮ���ܣ�1������������ˮ�����ᶡ������ˮ�����Կɼ��뱥��Na2CO3��Һ����һ����С���ᶡ����ˮ�е��ܽ�ȣ�Ȼ���Һ�ɵ����ᶡ�������Կ϶���Ҫ�Ļ�ѧ������AC��
��5��ʹ�÷�Һ©��ǰ����Ӧ����Ƿ�©ˮ���������Һ���������������ܷ�Һ©���Ͽڲ������ϵİ���δ��©�����ϵ�С������©���ڲ�δ����������ͨ��Һ�����ʱ����Һ©���ڵ�ѹǿ��С��Һ�������Ե��£����߲�����δ��Һ�岻�ܵ��¡�
���㣺���⿼��װ�õ�ѡ���л���Ӧԭ������ѧƽ�⡢���ʵķ��롣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ������У���ϵ��в��ԣ�һ����ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£����и���������ָ����Һ���ܴ����������
A��pH��1����Һ�У�Fe3+��Cl����NO3-��K+
B�������̪�Ժ�ɫ����Һ�У�Na+��Mg2+��AlO2-��NO3-
C���������۲���H2����Һ�У�Fe2+��Na+��SO42-��ClO��
D��c(SO32-)��0.1 mol��L��1����Һ�У�Na+��Cl����H+��Ca2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ�Ͼ��С��γ��и�����һ��ģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA Ϊ�����ӵ�������ֵ������˵����ȷ����
A����״���£�1.12LCCl4����C��Cl����ĿΪ0.2NA
B����״���£�2.24L�����к��е� Cl��Ŀһ��Ϊ0.2NA
Cl��Ŀһ��Ϊ0.2NA
C�����³�ѹ�£�4.4gCO2��N2O��������к��е�ԭ������Ϊ0.3NA
D��80mL 10mol��L��1 ����������MnO2���ȷ�Ӧ������Cl2������Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡï���и����ڶ��θ߿�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��ˮ��һ�ֵij��õĻ�ѧ�Լ���
(1)��Ũ��ˮ����ʯ��Ϊԭ�ϣ�������װ��Ϊ����װ�ã�����ȡ�� ����������֪��NH3��H2O+CaO=Ca(OH)2+NH3����

����ʯ��Ӧ��װ�� (��A��B)��
���Դӵ���ƽ��Ƕȷ�����ʵ���а����ݳ���ԭ�� ��
����Ҫ���Թܺͱ�Ҫʵ����Ʒ�ռ�һ�Թܰ���������C��������Ӧ�ռ�װ�á�
(2)��ѧ��ȤС���ð�ˮ����������Һ���ƺ�������Һ������ȩ��������Ӧʵ�飬������ͬѧʵ��ʱ�䳤����Ч�������ԡ�Ӱ����ȩ������Ӧ���ʵ���������Щ�أ�����������²��룺
�ٲ��룺����һ��������Һ��pH��С��
���ض��� ��
�������ʵ����֤����Ӱ������һ������±������ݡ�
�ṩ�Լ�����ȩ��2%ϡ��ˮ�� 0��25mol/L NaOH��Һ������ �� 2% AgNO3��Һ
ʵ����Ʒ���ձ�(װ����ˮ)���Թ�
ʵ�鲽�� | ʵ����� | Ԥ��������(����1ֻ������) |
1 | ��A��B��֧�ྻ���Թ��и���1mL 2%��AgNO3��Һ��Ȼ������Թܱ���ε���2%ϡ��ˮ������������ij���ǡ����ȫ�ܽ⣬��ʱ�Ƶ�pH��ԼΪ8��������Һ�� |
|
2 |
|
|
(3)��ȡ20��00ml ������ˮ����ƿ���μ�3�μ���ָʾ������0��0050mol/L������ζ����ζ������ֺ�ɫΪ�յ㣬�ظ�3��ʵ�飬ƽ�����ı�����20��04 ml,����������ˮ�����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡï���и����ڶ��θ߿�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��nAΪ�����ӵ���������ֵ������˵����ȷ����
A�������£�44 g CO2����nA��Cԭ��
B��1 L 0��1 mol��L-1 Na2S��Һ�к���0��1 nA��S2��
C��0��1 mol Na������O2��Ӧ��ת��0��2 nA������
D����״���£�22��4 L ��CCl4����4 nA��Clԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����и�������һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��0.1mol/L��Na2CO3����Һ�У����й�ϵʽ��ȷ����
A��c(Na+)>c(CO32-)> c(OH��)> c(H+)
B��c(OH��)= c(HCO3��)+ c(H2CO3)
C��2c(Na+)=c(CO32-)+ c(HCO3��)> c(H2CO3)
D��c(Na+)+ c(H+)= c(OH��) + c(HCO3��) +2c(CO32-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����и����ڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
Ϊ��̽��AgNO3�������Ժ����ȶ��ԣ�ij��ѧ��ȤС�����������ʵ�顣
��. AgNO3��������
����������˿����AgNO3��Һ�У�һ��ʱ�����˿ȡ����Ϊ������Һ��Fe�������������Һ�е�Ag+��������������ʵ�顣��ѡ���Լ���KSCN��Һ��NaOH��Һ����ˮ��KMnO4��Һ��
��������±���
���� | ���� | ���� |
ȡ��������Ag+�����Һ���Թ��У����� ���� |
| ����Fe3+ |
ȡ��������Ag+�����Һ���Թ��У�����1~2��KMnO4��Һ���� |
| ����Fe2+ |
��ʵ����ۡ�Fe����������Ϊ����Fe2+��Fe3+
��. AgNO3�����ȶ���
����ͼ��ʾ��ʵ��װ��A����AgNO3���壬��������ɫ���壬��װ��D���ռ�����ɫ���塣����Ӧ�����Ժ��Թ��в�������Ϊ��ɫ��
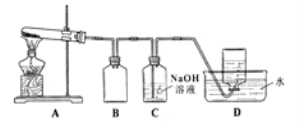
��.��װ��B�������� ��
�Ǿ�С�����۲���֤����ɫ����ΪO2������֤������ ��
�ȡ��������ϡ�Ag2O�ͷ�ĩ��Ag��Ϊ��ɫ��Ag2O�����ڰ�ˮ��
��������衿�Թ��в����ĺ�ɫ��������ǣ��� Ag���� Ag2O���� Ag��Ag2O��
��ʵ����֤����С��Ϊ��֤�������룬�ֱ�ȡ������ɫ���壬����������ʵ�顣
ʵ���� | ���� | ���� |
a | ����������ˮ���� | ��ɫ���岻�ܽ� |
b | ��������ϡ���ᣬ�� | ��ɫ�����ܽ⣬����������� |
��ʵ�����ۡ���������ʵ�飬����ȷ���������ɷֵ�ʵ���� ����ʵ���ţ���
��ʵ����ۡ���������ʵ�������ó�AgNO3�������ȷֽ�ķ���ʽΪ ��
��ʵ����չ��ȡ2.0g AgNO3��Ʒ������ȷֽ⣬���ռ����������������Ϊ336mL������Ʒ��AgNO3�İٷֺ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ��Զ�и���4��ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
25��ʱ��ijŨ�ȵ�NH4Cl��ҺpH = 4������������ȷ����
A����Һ�е� c(OH��) = 1��10��10 mol��L��1
B����Һ�е�c(NH4+)��c(Cl��)��c(H+)��c(OH��)
C����Һ�е�c(H+) + c(NH4+) = c(Cl��) + c(OH��)
D����Һ�е�c(NH3��H2O) = c(NH4+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����з�خ���߿�ͳ����һ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ˮ��Һ���ܴ��������һ���ǣ�������
A��Ba2+��Na+��SO32-��Cl? B��MnO4? ��SO42? ��K+ ��H+
C��Al3+ ��Mg2+��NO3? ��HCO3? D��Fe3+��Na+��SCN? ��Cl?
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com