
分析 (1)根据氢气物质的量以及燃烧热、丙烷物质的量以及燃烧热,列式求出混合气体完全燃烧释放的热量;
(2)依据两个热化学方程式结合题干数据列式计算得到;
(3)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式.
解答 解:(1)1molH2和2molC3H8组成的混合气体完全燃烧释放的热量为1mol×285.8kJ•mol-1+2mol×2220kJ•mol-1=4725.8kJ,故答案为:4725.8kJ;
(2)设混合气中H2的物质的量为x,则C3H8的物质的量为5mol-x.根据题意,列方程为:
285.8kJ/mol×x+2220.0kJ/mol×(5mol-x)=3847kJ
解得 x=3.75 mol;C3H8的物质的量为5mol-3.75mol=1.25mol.
所以混合气体中H2与C3H8的体积比即物质的量之比为3:1,
故答案为:3:1;
(3)已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(1)△H=-2220.0kJ/mol
②H2O(1)=H2O(g)△H=+44.0kJ/mol
由盖斯定律可知,①+②×4得C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol.
故答案为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol.
点评 本题考查了热化学方程式书写和盖斯定律计算应用,为高频考点,侧重考查化学反应热的有关计算分析,燃烧热概念分析应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 四氯化碳(CCl4)含有的碳原子数目为NA | |
| B. | CO2通过Na2O2使其增重5.6g时,反应中转移的电子数为0.4 NA | |
| C. | 0.2mol Fe与0.2 mol Cl2反应时失电子数为0.6NA | |
| D. | 常温常压下,29.8 g KCl与NaClO的固体混合物中阴离子的数目为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
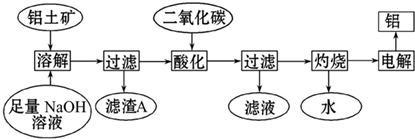
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
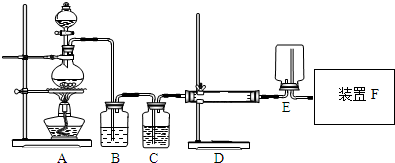

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
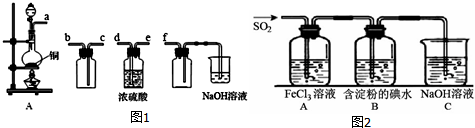
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
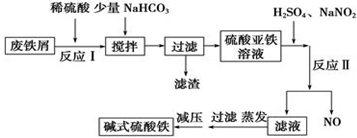
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
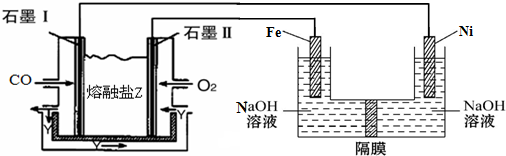
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ•mol-1 | B. | 2H2(g)+O2(g)=2H2O(l)△H=+484kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-242kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
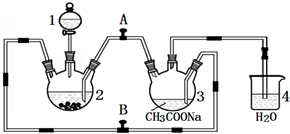 二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:
二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | V(NaOH) | V (HCl)/mL | c(NaOH) | ||
| ml | 初读数 | 终读数 | 体积 | mol/L | |
| 1 | 16.02 | 0.00 | 16.69 | 16.69 | 0.1042 |
| 2 | 16.71 | 0.00 | 17.90 | 17.90 | |
| 3 | 19.52 | 0.00 | 20.79 | 20.79 | 0.1065 |
| 4 | 14.99 | 0.00 | 16.02 | 16.02 | 0.1069 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com