
 甲醇是人们开发和利用的一种新能源.已知:
甲醇是人们开发和利用的一种新能源.已知:分析 (1)②+①得CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l),依据盖斯定律计算反应热,写出热化学方程式;
(2)反应焓变△H=生成物总能量-反应物总能量,据此解答;
(3)燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量.
解答 解:(1)①2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol;
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H2=-192.9kJ/mol;
由盖斯定律②+①得到甲醇蒸气完全燃烧的热化学反应方程式为:CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O△H2=-764.7kJ/mol;
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H2=-764.7kJ/mol;
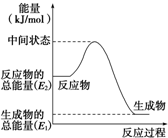
(2)反应②中的能量变化如图所示,依据图象分析,反应焓变△H=生成物总能量-反应物总能量,△H2=E1-E2,
故答案为:E1-E2kJ•mol-1;
(3)燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol,则氢气燃烧热为285.9KJ/mol,
故答案为:285.9 kJ•mol-1.
点评 本题考查了反应热的计算、热化学方程式的书写、燃烧热的概念,明确盖斯定律计算反应热的方法是解题关键,题目难度不大.


科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
实验室欲配制6.00 mol·L-1的H2SO4溶液,现有三种不同浓度的硫酸:①240 mL 1.00 mol/L的硫酸 ②150 mL 3.00 mol·L-1的硫酸 ③足量的18.00 mol·L-1的浓H2SO4。配制要求:①、②两种硫酸全部用完,不足部分由③补充。选用容量瓶的规格是( )
A. 100 mL B. 250 mL C. 500 mL D. 1000 mL
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡逆向移动了 | B. | 物质A的转化率减小了 | ||
| C. | 物质B的质量分数增大了 | D. | 反应速率增大,且v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ②③④⑥⑧ | C. | ①②③④⑤ | D. | ②③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A是一种重要的化工原料,用来衡量一个国家的石油化工发展水平,相同条件下存在如下转化关系(部分反应物、反应条件和产物已省略),其中E为具有果香气味的物质,F是高聚物.
A是一种重要的化工原料,用来衡量一个国家的石油化工发展水平,相同条件下存在如下转化关系(部分反应物、反应条件和产物已省略),其中E为具有果香气味的物质,F是高聚物.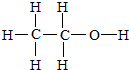 ;写出其官能团的电子式
;写出其官能团的电子式 ,1个该官能团含有9个电子,氢氧根与其组成元素相同,电子式为
,1个该官能团含有9个电子,氢氧根与其组成元素相同,电子式为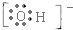 ,含有有10个电子;高聚物F是常用的塑料之一,它的链节可表示为-CH2CH2-.
,含有有10个电子;高聚物F是常用的塑料之一,它的链节可表示为-CH2CH2-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com