
【题目】甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
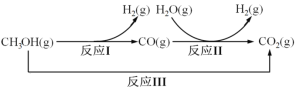
(1)已知一定条件下
反应I:CH3OH(g)==CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g) =CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是___。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率见图。
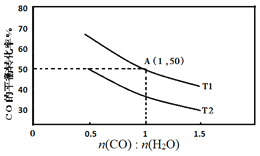
①比较T1、T2的大小,并解释原因___。
②A点对应的化学平衡常数是___。
③T1温度时,按下表数据开始反应建立平衡。
CO | H2O | H2 | CO2 | |
起始浓度(mol/L) | 2 | 1 | 0 | 0 |
t时刻浓度(mol/L) | 1.2 | 0.2 | 0.8 | 0.8 |
反应进行到t时刻时,判断v(正)、v(逆)的大小关系为:v(正)__v(逆)(填“>”“<”或“=”)。
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___。
(3)在经CO2饱和处理的KHCO3电解液中,电解活化CO2可以制备乙醇,原理如图所示。
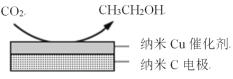
①阴极的电极反应式是___。
②从电解后溶液中分离出乙醇的操作方法是___。
【答案】H2O(g)+CO(g)=H2(g)+CO2(g) ΔH=-41.2kJ·mol-1 T1<T2,该反应(或者反应II)的ΔH<0,升高温度平衡逆向移动;图像表明,进气比相同时,温度由T1变为T2时CO转化率减小,平衡逆向移动,可知T1<T2 1 v(正)<v(逆) 进气比越大,反应温度越低 2CO2+12e-+12H+=CH3CH2OH+3H2O 蒸馏
【解析】
(1)由题目所给反应过程图可知,反应II为H2O(g)+CO(g)=H2(g)+CO2(g),根据盖斯定律,可知反应II=反应III-反应I,则该反应的ΔH=-41.2kJ·mol-1;
(2)①该反应(或者反应II)的ΔH<0,升高温度平衡逆向移动;图像表明,进气比相同时,温度由T1变为T2时CO转化率减小,平衡逆向移动,可知T1<T2;
②根据题目所给信息可列三段式

则反应平衡常数K=![]() ;
;
③t时刻时,![]() ,所以v(正)<v(逆);
,所以v(正)<v(逆);
④根据题目信息可知进气比越大,反应温度越低;
(3)①阴极2CO2放电,电极反应式为2CO2+12e-+12H+=CH3CH2OH+3H2O;
②电解后溶液中分离出乙醇的操作方法是蒸馏


科目:高中化学 来源: 题型:
【题目】在相同温度下,0.01 mol/L的NaOH溶液和0.01 mol/L的盐酸相比较,下列说法正确的是( )
A.由水电离出的c(OH-)相等
B.由水电离出的c(H+)都是1.0×10-12 mol/L
C.两溶液的pH之和等于14
D.若将0.01 mol/L的盐酸换成同浓度的醋酸,对水的电离的影响不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
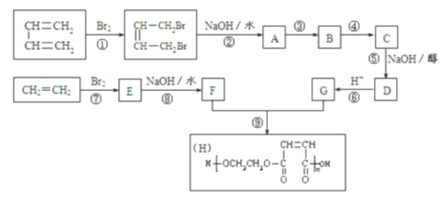
请按要求填空:
(1)写出上述指定反应的化学反应类型:
反应①____________,反应⑤______________,反应⑧________________。
(2)反应②的化学方程式是___________________________________________。
(3)反应③、④中有一反应是与HCl加成,该反应是__________(填反应编号),设计这一步反应的目的是___________________,物质C的结构简式是____________________。
(4)写出A的同分异构体(要求不含甲基并能发生银镜反应)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱晶体![]() 样品中常混有NaCl等杂质。某同学用沉淀法测定样品中
样品中常混有NaCl等杂质。某同学用沉淀法测定样品中![]() 的质量分数,操作流程如下:
的质量分数,操作流程如下:
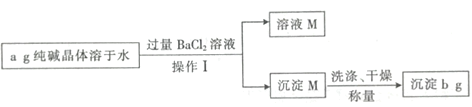
(1)写出加入![]() 溶液反应的离子方程式____;操作I所用到的玻璃仪器有烧杯、玻璃棒、____。
溶液反应的离子方程式____;操作I所用到的玻璃仪器有烧杯、玻璃棒、____。
(2)对沉淀M洗涤的方法是___。
(3)样品中![]() 的质量分数为___。
的质量分数为___。
(4)如果纯碱晶体失去部分结晶水(风化),则测定结果会___(填“偏高”、“偏低”或“不变”)。
(5)纯碱在生产生活中有广泛应用,用途正确的是_____。
A 用于治疗胃酸过多 B 用于生产玻璃 C 用于造纸 D 用于焙制糕点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年为“国际化学元素周期表年”。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是( )
![]()
A.原子半径:W<X
B.X的最高价氧化物的水化物是强碱
C.Y单质可用做半导体材料
D.气态氢化物热稳定性:Z<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的方案可以降低铁闸门的腐蚀速率。下列判断正确的是( )
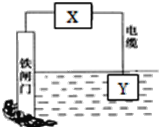
A.若X为导线,Y可以是锌
B.若X为导线,铁闸门上的电极反应式为Fe-2e-=Fe2+
C.若X为直流电源,铁闸门做负极
D.若X为直流电源,Y极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应在密闭容器中进行:A(g)+2B(g)3C(g) ΔH>0,如图中曲线a代表一定条件下该反应的过程,若使a曲线变为b曲线,可采取的措施是( )
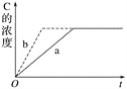
A.恒温恒容条件下将A、B的浓度增加一倍
B.恒温条件下加压(缩小容器体积)
C.使用合适的催化剂
D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
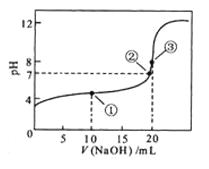
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com