
| 沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 |
| 生成物中含水溶性铜化合物的百分含量/% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 生成物中含酸溶性铜化合物的百分含量/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 |


科目:高中化学 来源: 题型:阅读理解
| 沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 |
| 生成物中含水溶性铜化合物的百分含量/% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 生成物中含酸溶性铜化合物的百分含量/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
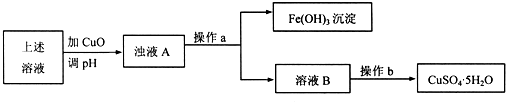
查看答案和解析>>
科目:高中化学 来源: 题型:
我国计划用8年时间对5·12四川汶川大地震进行灾后重建,重建需要大量钢材和金属合金材料。下列说法正确的是( )
A.铁和钢材的主要化学成分相同,性质也相同
B.硬铝(AlCuMgMnSi合金)可用于制造耐高温门窗
C.黄铜矿(CuFeS2)可冶炼出Cu、Fe,同时可制取硫酸
D.铁矿石是一种可再生资源,没有必要进行开采限制
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高三上学期化学一轮复习《从矿物到基础材料》专题综合测试(苏教版) 题型:选择题
我国计划用8年时间对5·12四川汶川大地震进行灾后重建,重建需要大量钢材和金属合金材料。下列说法正确的是( )
A.铁和钢材的主要化学成分相同,性质也相同
B.硬铝(AlCuMgMnSi合金)可用于制造耐高温门窗
C.黄铜矿(CuFeS2)可冶炼出Cu、Fe,同时可制取硫酸
D.铁矿石是一种可再生资源,没有必要进行开采限制
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com