
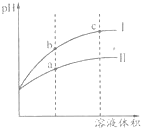
 某温度下pH=2的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )
某温度下pH=2的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | Ⅱ为盐酸稀释时pH变化曲线 | |
| B. | b点溶液的导电性比c点溶液的导电性强 | |
| C. | a点Kw数值比c点Kw数值大 | |
| D. | pH=2的盐酸和醋酸,盐酸的物质的量浓度大 |
分析 A.根据盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故II应为醋酸稀释时的pH值变化曲线;
B.利用c点、b点溶液中的离子浓度来分析导电性;
C.KW只与温度有关,与溶液的种类以及浓度大小没有关系;
D.相同pH值的盐酸和醋酸,稀释到相同体积时,醋酸(II)浓度大于盐酸(I)浓度.
解答 解:盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故II应为醋酸稀释时的pH值变化曲线;
A.II应为醋酸稀释时的pH值变化曲线,故A错误;
B.溶液导电性取决于离子浓度,b点的H+浓度大,离子总浓度大于c点,b点导电性强,故B正确;
C.KW的大小只取决于温度,相同温度下,ac点的KW相同,故C错误;
D.相同pH值的盐酸和醋酸,醋酸浓度远大于盐酸的浓度,稀释到相同体积时,醋酸(II)浓度大于盐酸(I)浓度,故D错误;
故选D.
点评 本题考查强弱电解质溶液稀释时的pH、浓度变化,注意加水促进弱电解质电离的特点,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlO2- | B. | Al3+ | C. | Al(OH)3 | D. | Al(OH)3和Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度的下列溶液,c(NH4+)大小顺序:(NH4)2SO4>NH4HSO4>NH4Cl>NH4HCO3 | |
| B. | 同浓度的下列溶液,pH值大小顺序:Na2CO3>NaClO>NaHCO3>CH3COONa | |
| C. | 用水冲洗BaSO4比用稀硫酸冲洗损失大 | |
| D. | 用惰性电极电解某溶液,两极分别产生H2和O2,pH值一定升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-2mol/L | B. | 1×10-7mol/L | C. | 1×10-12mol/L | D. | 1×10-14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液,c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | 0.1mol/L K2S溶液中,c(K+)=c(S2-)+c(HS-)+c(H2S) | |
| C. | 常温时pH=2的盐酸和pH=12的氨水中由水电离出的c(H+)相等 | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合完全反应后c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2是污染大气的有害气体之一 | |
| B. | SO2在大气中与水反应生成硫酸,产生酸雨 | |
| C. | SO2可使澄清石灰水变浑浊 | |
| D. | SO2能使品红溶液褪色,加热溶液颜色恢复 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
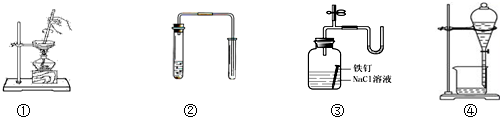
| A. | 装置①可用于加热蒸干氯化铵溶液得到氯化铵晶体 | |
| B. | 装置②可用于铜和稀硝酸制取并收集少量NO | |
| C. | 装置③可用于证明铁生锈氧气参与反应 | |
| D. | 苯萃取碘水中的碘后,从装置④下口放出的是碘的苯溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 范德华力、范德华力、离子键 | B. | 范德华力、共价键、共价键 | ||
| C. | 范德华力、范德华力、共价键 | D. | 共价键、共价键、共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com