
| A. | 只有②④ | B. | 只有①③ | C. | 只有①②③④ | D. | ①②③④⑤ |
分析 前者在一定的条件下能将后者从其化合物中置换出来,则前后的金属性大于后者或前者的氧化性大于后者,
①金属铝比铁活泼,可以将铁从其盐中置换出来;
②氧化性氯气比硫强,氯气能将硫置换出来;
③金属镁可以在二氧化碳中燃烧,金属镁置换出碳单质;
④氢气可以还原氧化铜,置换出金属铜;
⑤焦炭在高温下可以和二氧化硅反应,碳的氧化性强于硅.
解答 解:①Al比Fe活泼,Al能与氯化亚铁反应或通过铝热反应置换出Fe,故①正确;
②Cl2的氧化性大于S,氯气与硫化氢反应置换出S,故②正确;
③Mg的还原性大于C,则Mg与二氧化碳发生置换反应生成C,故③正确;
④H2与CuO发生置换反应生成Cu,故④正确;
⑤焦炭在高温下可以和二氧化硅反应生成硅和一氧化碳,碳的氧化性强于硅,所以碳可以置换硅,故⑤正确;
根据分析可知,正确的为:①②③④⑤,
故选D.
点评 本题考查元素化合物知识,为高频考点,题目难度中等,明确常见物质的性质、发生的反应为解答的关键,侧重氧化还原反应、置换反应的应用能力考查,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 和金属钠反应时断①键 | B. | 和乙酸反应时断②键 | ||
| C. | 在铜催化共热下与O2反应时断①③键 | D. | 在空气中完全燃烧时断①②③④⑤键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:X<Z | |
| B. | Y的氯化物为离子化合物 | |
| C. | W位于第3周期IA族,其原子半径比其他元素的都大 | |
| D. | 将2 mol W的单质和1 mol Y的单质投入足量的水中会产生2.5 mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
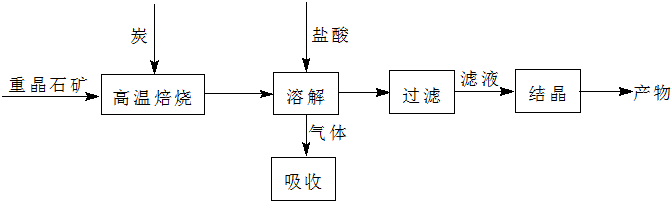
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g D216O中含有的中子数为9NA | |
| B. | 1molCH3COONa和少量CH3COOH溶于水形成的中性溶液中,CH3COO-数目小于NA | |
| C. | 常温常压下,甲醛和冰醋酸的混合物共6.0g,其中含有的原子总数为0.8NA | |
| D. | 将1molCH3CH2OH催化氧化为CH3COOH,消耗的O2分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度越高,酶的催化活性越强 | |
| B. | 浓硝酸使皮肤呈黄色是由于浓硝酸与蛋白质发生了显色反应 | |
| C. | 用灼烧的方法可以鉴别毛织物和棉织物 | |
| D. | 在豆浆中加入少量的石膏,能使豆浆凝结为豆腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
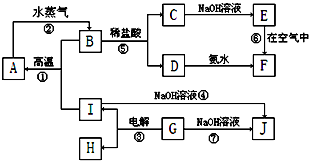
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com