
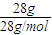 =1mol,
=1mol,

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
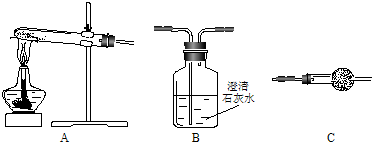
| 49n |
| 9m |
| 49n |
| 9m |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 49n |
| 9m |
| 49n |
| 9m |
查看答案和解析>>
科目:高中化学 来源: 题型:
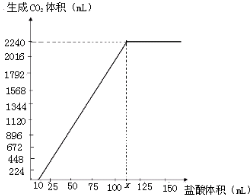 (2012?闸北区一模)碳酸钠和碳酸氢钠在生产、生活中都有重要的应用.现有3.58g Na2CO3和NaHCO3固体混合物,将其制成溶液后,边搅拌边逐滴滴加80.0mL 1.0mol/L盐酸,反应完全后生成的CO2气体折算成标准状况下的体积为896mL(设气体全部逸出,下同).(1)通过计算可知上述反应中
(2012?闸北区一模)碳酸钠和碳酸氢钠在生产、生活中都有重要的应用.现有3.58g Na2CO3和NaHCO3固体混合物,将其制成溶液后,边搅拌边逐滴滴加80.0mL 1.0mol/L盐酸,反应完全后生成的CO2气体折算成标准状况下的体积为896mL(设气体全部逸出,下同).(1)通过计算可知上述反应中查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 49n |
| 9m |
| 49n |
| 9m |
查看答案和解析>>
科目:高中化学 来源: 题型:
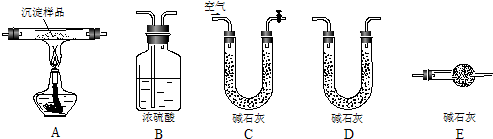
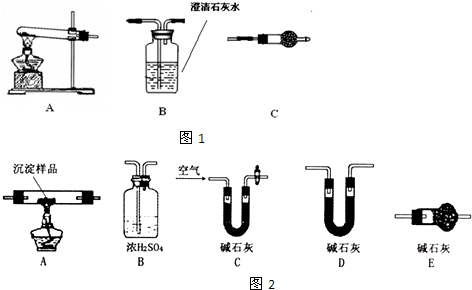
 (2010?陕西模拟)根据环保要求,在处理有氰电镀废水时,剧毒的CN-在催化剂TiO2颗粒作用下,先用NaClO将CN-氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2.环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率.
(2010?陕西模拟)根据环保要求,在处理有氰电镀废水时,剧毒的CN-在催化剂TiO2颗粒作用下,先用NaClO将CN-氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2.环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com