
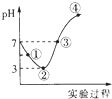
 常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | ①处c(H+)约为②处c(H+)两倍 | |
| B. | 曲线③④段有离子反应:HClO+OH-═H2O+ClO- | |
| C. | 可以依据②处数据计算所得溶解的氯气的量n(Cl2) | |
| D. | ③处表示氯气与氢氧化钠恰好反应完全 |
分析 整个过程发生的反应为Cl2+H2O?HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,①点所示溶液中发生反应:Cl2+H2O?H++Cl-+HClO,②点所示溶液中发生反应:Cl2+H2O?H++Cl-+HClO,HClO为弱电解质,部分电离,溶液中存在的粒子有:H+、Cl-、ClO-、OH-,H2O、HClO、Cl2,③点所示溶液中发生反应:HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,溶液呈中性,则c(H+)=c(OH-),④点溶液呈碱性,根据溶液的酸碱性结合盐类水解等知识分析解答.
解答 解:A.①处到②处是氯气的溶解平衡:Cl2+H2O?H++Cl-+HClO向右进行的过程,酸性逐渐增强,氢离子浓度逐渐增大,故A错误;
B.曲线③④段发生反应:HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,离子反应分别为:H++OH-=H2O、HClO+OH-═H2O+ClO-,故B正确;
C.②点所示溶液中发生反应:Cl2+H2O?H++Cl-+HClO,HClO为弱电解质,部分电离,无法根据pH计算参加反应的氯气,故C错误;
D.氯气与氢氧化钠恰好反应完全溶液为氯化钠、次氯酸钠溶液,溶液呈碱性,③点所示溶液中发生反应:HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,溶液呈中性,c(H+)=c(OH-),故D错误;
故选B.
点评 本题综合考查氯气的性质,题目难度中等,明确溶液中的溶质及其性质是解本题关键,注意盐的水解原理的应用方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾、漂白粉、臭氧的净水原理相同 | |
| B. | 硅胶可用作干燥剂 | |
| C. | 煤的干馏和石油的分馏都属于物理变化 | |
| D. | 亚硝酸钠是一种食品防腐剂,使用时其用量可以不加限制 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表里,主族元素所在的族序数等于原子核外电子数 | |
| B. | 周期表里,元素所在的周期序数等于原子核外最外层电子数 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于悬浊液 | |
| B. | 所得的分散系中分散质为Fe2O3 | |
| C. | 该分散系能产生丁达尔效应 | |
| D. | 所得分散系为胶体,且胶粒直径即为氢氧化铁分子直径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 当有3molClO-参加反应时,则有1molN2生成 | |
| B. | HCO3-作为碱性介质参与反应 | |
| C. | 当有5molClO-参加反应时,则有1molN2生成 | |
| D. | 若生成2.24LN2,则转移电子0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com