
| A�� | �÷�Ӧ�ﵽƽ��״̬ | |
| B�� | �÷�Ӧ������������� | |
| C�� | ��ƽ��״̬ʱ��H2��ת����ӦΪ96.3% | |
| D�� | ����H2�������÷�Ӧƽ�ⳣ������С |
���� ��������ʽ��ʽ���㣬������ת����Ϊ50%ʱ��Ӧ������Ũ��Ϊ0.2mol/L��
H2 +I2 =2HI��g��
��ʼ����mol/L�� 0.4 1 0
�仯����mol/L�� 0.2 0.2 0.4
ijʱ�̣�mol/L�� 0.2 0.8 0.4
Q=$\frac{0��{4}^{2}}{0.2��0.8}$=1��K=64����Ӧδ�ﵽƽ��״̬����Ӧ������У��ݴ˽��A��B��C��
D�����ƽ��ʱ����������Ũ�ȣ�Ȼ������ƽ�ⳣ������ʽ��ʽ���㼴�ɣ�
��� �⣺��������ʽ��ʽ���㣬������ת����Ϊ50%ʱ��Ӧ������Ũ��Ϊ0.2mol/L��
H2 +I2 =2HI��g��
��ʼ����mol/L�� 0.4 1 0
�仯����mol/L�� 0.2 0.2 0.4
ijʱ�̣�mol/L�� 0.2 0.8 0.4
Q=$\frac{0��{4}^{2}}{0.2��0.8}$=1��K=64����Ӧδ�ﵽƽ��״̬����Ӧ������У�
A�����ݷ�����֪��������ת����Ϊ50%ʱû�дﵽƽ��״̬����A����
B���÷�Ӧ������������У���B����
C����������ʽ��ʽ���㣬ƽ��ʱ����ת��Ũ��x��
H2 +I2 =2HI��g��
��ʼ����mol/L�� 0.4 1 0
�仯����mol/L�� x x 2x
ƽ������mol/L�� 0.4-x 1-x 2x
K=$\frac{4{x}^{2}}{��0.4-x����1-x��}$=64
��ã�x��0.38mol/L��
���Դﵽƽ��ʱ����ת����Ϊ��$\frac{0.38mol/L}{0.4mol/L}$��100%=96.3%����C��ȷ��
D���������������������¶Ȳ��䣬�÷�Ӧ��ƽ�ⳣ�����䣬��D����
��ѡC��
���� ���⿼�黯ѧƽ����㣬��Ŀ�Ѷ��еȣ���ȷ��ѧƽ�⼰��Ӱ��Ϊ���ؼ���ע����������ʽ�ڻ�ѧƽ�������Ӧ�÷���������������ѧ���ķ�����������ѧ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v��H2��=0.8mol/��L•s�� | B�� | v��N2��=0.4mol/��L•s�� | ||
| C�� | v��NH3��=0.6mol/��L•s�� | D�� | v��H2��=4.2mol/��L•min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na����ˮ�У��������壺2Na+2H2O�T2Na++2OH-+H2�� | |
| B�� | �ô�����������β���е�CO��NO��2CO+2NO$\frac{\underline{\;����\;}}{\;}$2CO2+N2 | |
| C�� | NaOH��Һ���ܱ����ڲ��������Լ�ƿ�У�SiO2+2OH-�TSiO32-+H2O | |
| D�� | ���ȵ���˿��ˮ�����Ӵ��������γɺ�ɫ�����㣺2Fe+3H2O������$\frac{\underline{\;\;��\;\;}}{\;}$Fe2O3+3H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ����ڹ����Ĵ�����ȼ�տ������ɴ�����SO3 | |
| B�� | ������Ʒ����Һ����SO2��CO2 | |
| C�� | SO2��ʹƷ����Һ������KMnO4��Һ��ɫ������ɫԭ����ͬ | |
| D�� | ����SO2ͨ��CaCl2����Һ�����ɰ�ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
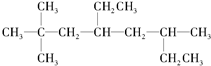 ��ϵͳ������������A2��2��6-����-4-�һ����飻��A��һ�ȴ�����в�ͬ�е�IJ�����10�֣�����A�ɵ�ϩ����H2�ӳ����ã���ԭ��ϩ����8�ֽṹ��
��ϵͳ������������A2��2��6-����-4-�һ����飻��A��һ�ȴ�����в�ͬ�е�IJ�����10�֣�����A�ɵ�ϩ����H2�ӳ����ã���ԭ��ϩ����8�ֽṹ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ɱ� | B�� | Һ�� | C�� | Һ�� | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ̼������Һ�м����Ȼ�����Һ�������� | |
| B�� | ͭ���ڿ����м��ȱ�ɺ�ɫ��ĩ | |
| C�� | ʯ��ʯ�������Ტ������ɫ��ζ������ | |
| D�� | Һ���ڿ����б�Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Һ̬�����ռ��� | B�� | ���ס���ʯ�ҡ���ʯ�� | ||
| C�� | �����ɱ����Ȼ��� | D�� | ���������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com