
| A. | 0.1mol•L-1Fe(NO3)2溶液:Mg2+、H+、SO${\;}_{4}^{2-}$、Cl- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$、Na+ | |
| C. | Na2O2溶于水产生O2:2O22-+2H2O═O2↑+4OH- | |
| D. | 用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
分析 A.硝酸根离子在酸性条件下能够氧化亚铁离子;
B.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.过氧化钠在离子方程式中不能拆开,应该保留化学式;
D.酸性溶液中,反应产物不能生成氢氧根离子.
解答 解:A.Fe(NO3)2在溶液中电离出Fe2+和NO3-,Fe2+、NO3-、H+发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中存在大量氢氧根离子,K+、AlO2-、CO32-、Na+之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.Na2O2与水反应生成氢氧化钠和O2,正确的离子方程式为:2Na2O2+2H2O═4Na++O2↑+4OH-,故C错误;
D.用过氧化氢从酸化海带灰浸出液中提取碘,产物中不会生成氢氧根离子,正确的离子方程式为:2I-+2H++H2O2═I2+2H2O,故D错误;
故选B.
点评 本题考查了离子共存、离子方程式的书写判断,题目难度中等,明确离子反应发生条件、离子方程式的书写原则为解答关键,A为易错点,注意硝酸根离子在酸性条件下具有强氧化性,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
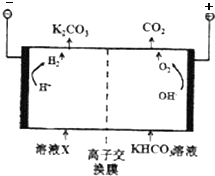 火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.
火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ•mol-1 | 890.3 | 1299.6 | 285.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极 | |
| C. | 负极发生还原反应,正极发生氧化反应 | |
| D. | 外电路电子流入的一极为正极,电子流出的一极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.080 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>Y>X | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物的水化物的碱性:Y>R>X | |
| D. | 气态氢化物的稳定性:Z>T |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com