
| A. | 一定不含Fe3+和Fe2+ | |
| B. | 一定含有Fe3+,但一定不含Fe2+ | |
| C. | 一定含有Al3+,Fe2+、Fe2+含有一种或两种 | |
| D. | 溶液可能含有NO3- |
分析 向该溶液中加入一定量1mol/L NaOH溶液的过程中,开始没有沉淀,说明溶液呈酸性,则一定含有大量的H+离子,在酸性溶液中AlO2-、CO32-离子因发生反应生成弱电解质而不能存在;而后才有沉淀.能够生成沉淀的是Fe3+离子、Fe2+离子或Al3+离子中的一种或几种,沉淀达最大量后继续滴加NaOH溶液沉淀部分消失.说明一定含有Al3+;结合溶液的电中性和Fe2+离子的还原性以及NO3-离子的氧化性做进一步的推断.
解答 解:向该溶液中加入一定量1mol/L NaOH溶液的过程中,开始没有沉淀,说明溶液呈酸性,则一定含有大量的H+离子,
在酸性溶液中AlO2-、CO32-离子分别与H+离子反应生成Al(OH)3沉淀、CO2气体而不能存在,
根据溶液的电中性可知一定含有阴离子,则只有NO3-离子符合;
而后才有沉淀.能够生成沉淀的是Fe3+离子、Fe2+离子或Al3+离子中的一种或几种,但在酸性条件下Fe2+离子与NO3-离子发生氧化还原反应而不能共存,则一定不含Fe2+离子,沉淀达最大量后继续滴加NaOH溶液沉淀部分消失.说明一定含有Al3+和Fe3+;
综上所述,溶液中一定含有H+离子、NO3-离子,一定没有AlO2-、CO32-、Fe2+离子,一定含有Fe3+离子、Al3+;
A、依据判断可知一定含Fe3+离子,一定不含有Fe2+离子,故A错误;
B、根据分析判断结果可知一定含Fe3+离子,Fe2+离子一定不存在,故B正确;
C、溶液中一定含有H+离子、NO3-离子,一定没有AlO2-、CO32-、Fe2+离子,一定含有Fe3+离子、Al3+,故C错误;
D、依据分析和溶液中电荷守恒可知,阴离子只有NO3-离子,所以一定存在NO3-离子,故D错误,故选B.
点评 本题考查常见离子的检验,注意从反应的现象推断离子的存在性,把握物质的性质和离子的检验方法是做本题的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④⑤ | C. | ①③⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
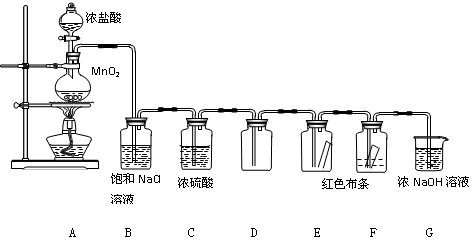
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 与足量NaOH溶液反应的化学方程式为CH3CBr(COOH)CH3+2NaOH→CH3C(OH)(COONa)CH3+NaBr+H2O.
与足量NaOH溶液反应的化学方程式为CH3CBr(COOH)CH3+2NaOH→CH3C(OH)(COONa)CH3+NaBr+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com