
| A. | 标况下,22.4升的H2O含有的水分子数为NA | |
| B. | 标况下,11.2升CCl4中含有的Cl原子数为2NA | |
| C. | 17克NH3中含有的电子总数为10NA | |
| D. | 0.5mol/L的H2SO4溶液中含有的H+数为NA |
分析 A.标准状况下水的状态不是气体;
B.标况下四氯化碳不是气体,不能使用标况下的气体摩尔体积计算;
C.氨气分子中含有10个电子,根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算;
D.缺少溶液体积,无法计算溶液中含有氢离子数目.
解答 解:A.标况下水不是气体,不能使用标况下的气体摩尔体积计算,故A错误;
B.标准状况下四氯化碳不是气体,不能使用标况下的气体摩尔体积计算四氯化碳的物质的量,故B错误;
C.17克NH3的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol氨气分子中含有10mol电子,含有的电子总数为10NA,故C正确;
D.没有告诉该硫酸溶液的体积,无法计算溶液中氢离子的物质的量及数目,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,明确标况下气体摩尔体积的使用条件为解答关键,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


科目:高中化学 来源: 题型:解答题
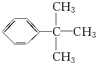 ;乙能被高锰酸钾酸性溶液氧化为分子式C8H6O4的羧酸,则乙可能的结构有9种.
;乙能被高锰酸钾酸性溶液氧化为分子式C8H6O4的羧酸,则乙可能的结构有9种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体带正电 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 由于胶体是一种介稳性的分散系,因此不易聚沉 | |
| D. | 胶体能够发生丁达尔现象,而溶液则不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═A1O2-+2H2↑ | |
| B. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- | |
| C. | 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 向苯酚钠溶液中通入少量的CO2:2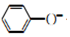 +CO2+H2O→2 +CO2+H2O→2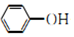 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,滴加几滴KSCN溶液,振荡 | 溶液呈血红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,滴加几滴K3[Fe(CN)6]溶液,振荡 | 产生蓝色沉淀 | 存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H4=(△H1+△H2-3△H3)×$\frac{1}{3}$ | B. | △H4=(3△H3-△H1-△H2)×$\frac{2}{3}$ | ||
| C. | △H4=(△H1+△H2-3△H3)×$\frac{2}{3}$ | D. | △H4=(△H1-△H2-3△H3)×$\frac{3}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,等质量的N2和CO气休的原子数均为2NA | |
| B. | 在反应KC1O4+8HCI=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA | |
| C. | 含有3mol离子的过氧化钠固体和足量的水反应,电子转移数为NA | |
| D. | 标准状况下,80gSO3中含3NA个氧原子,体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 硫酸钾中阴离子所带电荷数为NA | |
| B. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NAFe3+ | |
| C. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA个氢原子 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com