
| △c |
| △t |
| ||
| △t |
| 0.02mol |
| 5L |
| 0.01mol |
| 5L |
| 0.18mol |
| 5L |
| △c |
| △t |
| ||
| △t |
| ||
| 0.5min |
| c2(SO3) |
| c2(SO2)?c(O2) |
| (0.036)2 |
| (0.004)2×(0.002) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
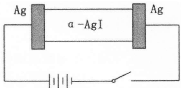 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )| A、若α-AgI是Ag+导电,则通电一段时间后晶体质量不变 |
| B、若α-AgI是Ag+导电,则通电一段时间后晶体质量减少 |
| C、阳极反应为:Ag一e-=Ag+ |
| D、阴极质量不断增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
| C、常温下,等物质的量浓度的三种溶液①(NH4)2SO4 ②NH4Cl③(NH4)2Fe(SO4)2中c(NH4+):②<①<③ |
| D、0.1mol?L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |



查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2O) |
| n(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X+离子核外有10个电子;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X+离子核外有10个电子;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 环境污染 |  白色污染 |
 雾霾 |
 臭氧空洞 |
 酸雨 |
| 产生原因 | 生活污水的排放 | 汽车尾气的排放 | 氟利昂的使用 | 煤的直接燃烧 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3-CH2-NO2和N2H-CH2-COOH互为同分异构体 |
| B、O2和O3互为同素异形体 |
| C、CH3CH3和CH3CH3CH互为同系物 |
| D、干冰和冰为同一种物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com