
【题目】25℃时,向1L0.01 molL-1H2B溶液中滴加盐酸或NaOH溶液,溶液中 c(H2B)、c(HB-)、c(B2-)、c(OH-)、c(H+) 的对数值(lgc)与pH的关系如图所示(温度保持不变),下列说法错误的是
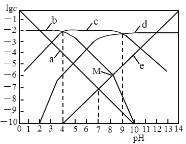
A.曲线c表示lgc(HB-)与pH的关系
B.随pH增加,c(H2B)c(OH-)增大
C.0.01 molL-1Na2B溶液,Kh1(B2-)的数量级为10-9
D.M点溶液中n(Na+)+n(H+)―n(B2-)=0.01mol
【答案】BC
【解析】
pH=-lgc(H+),所以a曲线代表c(H+),e曲线代表c(OH-);H2B可以NaOH发生反应H2B+NaOH=NaHB+H2O,NaHB+NaOH=Na2H+H2O,所以随溶液pH增大,c(H2B)逐渐减小,c(HB-)先增多后减小,c(B2-)逐渐增大,所以b代表c(H2B),c代表c(HB-),d代表c(B2-)。
A.根据分析可知曲线c表示lgc(HB-)与pH的关系,故A正确;
B.HB-的水解平衡常数的表达式为Kh=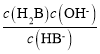 ,所以c(H2B)c(OH-)=Kh·c(HB-),而随pH增加,c(HB-)先增大后减小,水解平衡常数不变,所以c(H2B)c(OH-)先增大后减小,故B错误;
,所以c(H2B)c(OH-)=Kh·c(HB-),而随pH增加,c(HB-)先增大后减小,水解平衡常数不变,所以c(H2B)c(OH-)先增大后减小,故B错误;
C.Kh1(B2-)=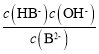 ,据图可知当c(B2-)= c(HB-)时溶液的pH=9,所以此时溶液中c(OH-)=10-5mol/L,则Kh1(B2-)=10-5mol/L,故C错误;
,据图可知当c(B2-)= c(HB-)时溶液的pH=9,所以此时溶液中c(OH-)=10-5mol/L,则Kh1(B2-)=10-5mol/L,故C错误;
D.M点溶液中存在电荷守恒2c(B2-)+c(HB-)+c(OH-)= c(Na+)+ c(H+),因为在同一溶液中,所以2n(B2-)+n(HB-)+n(OH-)=n(Na+)+n(H+),存在物料守恒n(B2-)+n(HB-)+n(H2B)=0.01mol,据图可知该点n(OH-)=n(H2B),所以n(B2-)+n(HB-)+n(OH-)=0.01mol,根据物料守恒可知n(HB-)+n(OH-)=n(Na+)+n(H+)-2n(B2-),带入可得n(Na+)+n(H+)―n(B2-)=0.01mol,故D正确;
故答案为BC。


科目:高中化学 来源: 题型:
【题目】在密闭容器中进行A(g)+2B(s)![]() 2C(s)+3D(s) ΔH>0的反应,下列说法正确的是( )
2C(s)+3D(s) ΔH>0的反应,下列说法正确的是( )
A. 升高温度,正反应速率增大,逆反应速率减小
B. 容器内气体平均相对分子质量不变时达到化学平衡状态
C. 温度不变,增大B的投入量,正反应速率增大
D. 温度不变,压缩容器体积重新达到平衡后,A的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用一定浓度的盐酸溶液滴定某氨水溶液。滴定终点附近溶液pH和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点,溶液总体积变化忽略不计)。下列说法错误的是
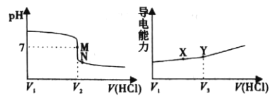
A.M点对应溶液中c(NH4+)=c(Cl-)
B.X→Y溶液导电性增强的主要原因是c(H+)和c(Cl-)增大
C.根据溶液pH和导电能力的变化可判断V2<V3
D.M→N过程中 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关NaHCO3和Na2CO3的性质,以下叙述错误的是
A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积小
B.等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍
C.等质量NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多
D.等物质的量的NaHCO3和Na2CO3与足量盐酸反应产生CO2一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaBiO3为浅黄色或褐色沉淀。NaBiO3与硝酸酸化的MnSO4溶液发生反应:5NaBiO3+2Mn2++14H+=2MnO![]() +5Bi3++5Na++7H2O。下列推断正确的是
+5Bi3++5Na++7H2O。下列推断正确的是
A.上述反应中的MnSO4溶液也可以用盐酸或硫酸酸化
B.可用BiO![]() 检验Na+的存在
检验Na+的存在
C.由上述反应可知氧化性:NaBiO3>HNO3>KMnO4
D.NaBiO3与浓盐酸反应的离子方程式为:NaBiO3+2Cl-+6H+=Bi3++Na++3H2O+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自2020年7月1日起,在全国范围内实行轻型汽车国Ⅵ排放标准,该标准对氮氧化物、碳氢化物(HC)、一氧化碳和悬浮粒子等排放物的限制将更为严苛。
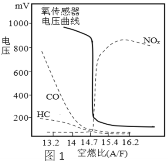
(1)空燃比(A/F:空气质量与燃油质量之比)对尾气排放、发动机动力等都有很大影响。利用氧传感器测定可找到最佳空燃比区域(曲线如图1)。由图可知最佳空燃比区域为___附近,理由是________。推广使用无铅汽油的优点是____________。
(2)汽车尾气通过三元催化装置净化的原理是:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H1
2CO2(g)+N2(g) △H1
已知:① N2(g)+O2(g)=2NO(g) △H2
② C(s)+O2(g)=CO2(g) △H3
③ C(s)+![]() O2(g)=CO(g) △H4
O2(g)=CO(g) △H4
则△H1=_______(用含△H2、△H3、△H4的关系式表示)。
(3)选择性催化还原技术(SCR)利用氨或尿素将NOx还原为N2和H2O,原理是:NO(g)+NO2(g)+2NH3(g) ![]() 3H2O(g)+2N2(g) △H
3H2O(g)+2N2(g) △H
①其他条件不变时,NO的转化率与温度、压强的关系如图2所示。则△H_____0,p1 ____ p2(填“>”或“<”)。
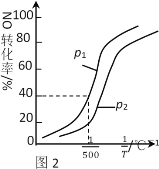
②在500℃时,2L密闭容器中充入1molNO、1molNO2和2molNH3,达平衡时压强为p1MPa。则500℃时该反应的平衡常数Kp=_______。
(4)汽车尾气中还存在NH3等,含氮化合物广泛应用于化工、化肥、制药等领域。
①已知N2H4在水溶液中的一级电离方程式为N2H4H2O![]() +OH-,则
+OH-,则![]() 的电子式为________________。
的电子式为________________。
②已知:Ag+(aq) +2NH3(aq)[Ag(NH3)2]+(aq),其平衡常数表达式为Kf =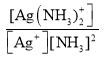 =1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc molL-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=_____molL-1(保留三位有效数字,提示:
=1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc molL-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=_____molL-1(保留三位有效数字,提示:![]() ≈3.16)。
≈3.16)。
查看答案和解析>>
科目:高中化学 来源: 题型:
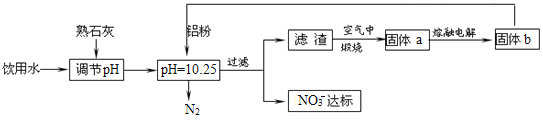
【题目】饮用水的质量关系到关系到每个人的健康,因含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(II),使其失去携氧功能,为了降低饮用水中NO3-的浓度,某兴趣小组提出如图方案:
请回答下列问题:
(1)人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某种麦片中含有微量、颗粒细小的还原铁粉,这些铁粉在人体胃酸(胃酸的主要成分是HCl)作用下转化成亚铁盐。写出该反应的离子方程式:____。
(2)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3-反应的离子方程式为__。
(3)该方案中选用熟石灰调节pH,理由是___、___。
(4)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为___。
(5)饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如图,试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是____。
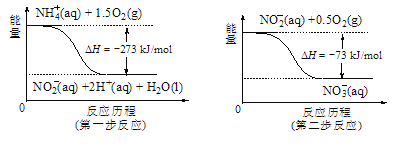
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.NH4HCO3溶于过量的浓KOH溶液中:HCO![]() +2OH-=CO
+2OH-=CO![]() + H2O
+ H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO![]() 沉淀完全:2Al3++3SO
沉淀完全:2Al3++3SO![]() +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2 Fe3++Br2+4 Cl-
D.向氢氧化铁中加入HI溶液:2Fe(OH)3+6H+ +2I—= 2Fe2+ + I2 +6 H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com