
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
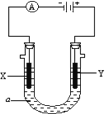
(1)若要在铁制品表面镀上一层银,则
①X电极的材料是____,电极反应式____________
②Y电极反应式__________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极反应式_______________
②Y电极的材料是_______,电极反应式___________________(杂质发生的反应不必写出).
③假若电路中有0.04摩尔电子通过时,阴极增重________克。
【答案】 铁 Ag++e-=Ag Ag-e-=Ag+ Cu2++2e-=Cu 粗铜 Cu-2e-=Cu2+ 1.28
【解析】分析:(1)若要在铁制品表面镀上一层银,铁作阴极,银作阳极,硝酸银溶液作电解质溶液;
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,粗铜作阳极,纯铜作阴极,据此解答。
详解:(1)①X电极与电源的负极相连,作阴极;Y电极与电源的正极相连,作阳极。因此若要在铁制品表面镀上一层银,则X电极的材料是铁,银离子放电,电极反应式为Ag++e-=Ag;
②Y电极是银电极,银失去电子,反应式为Ag-e-=Ag+。
(2)①如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极是纯铜,铜离子放电,反应式为Cu2++2e-=Cu;
②Y电极是阳极,其电极的材料是粗铜,电极反应式为Cu-2e-=Cu2+;
③假若电路中有0.04mol电子通过时,则根据Cu2++2e-=Cu可知阴极析出0.02mol铜,因此阴极增重0.02mol×64g/mol=1.28g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某学生在如图所示的装置中用苯和液溴制取溴苯,请根据下列实验步骤回答有关问题. 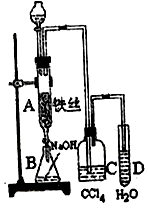
(1)写出A中发生的有机反应的化学方程式;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 , 然后用仪器分离出溴苯(仍含有少量苯);
(3)反应完毕后,向试管D中滴加AgNO3溶液有(填现象)生成,此现象说明这种获得溴苯的反应属于反应(填有机反应类型)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细胞中化学元素的叙述,正确的是( )
A. 在人体细胞干重中含量最高的元素是O
B. 在人体活细胞中氢原子的数目最多
C. Cu、Mn、Mg、B是组成细胞的微量元素
D. 一种元素的作用能被其它元素替代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是
A. 充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性不变
D. 放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列图像的描述正确的是
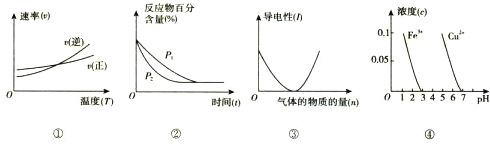
A. 根据图①判断反应A2(g)+3B2(g) ![]() 2AB3(g)的 △H>0
2AB3(g)的 △H>0
B. 图②可表示压强(P)对反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
C. 图③可表示向醋酸溶液通入氨气时,溶液导电性随氨气量的变化
D. 根据图④,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量是科学研究的重要方法。相同质量的铁粉与足量稀硫酸分别在下列条件下发生反应,其中反应速率最快的是
A | B | C | D | |
t/℃ | 10 | 10 | 40 | 40 |
c(H2SO4 )/(mol/L) | 1 | 3 | 1 | 3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知弱酸的电离常数:K(CH3COOH)=1.8×10﹣5;K1(H2CO3)=4.4×10﹣7;K2(H2CO3)=4.7×10﹣11;K(HClO)=4.0×10﹣8 . 则下列说法正确的是( )
A.25℃时,0.1mol/L的醋酸溶液比0.01mol/L的醋酸溶液的K值小
B.25℃时,甲基橙滴入0.1mol/L的醋酸溶液中,溶液呈黄色
C.新制氯水与碳酸氢钠不反应
D.等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH:pH[Na2CO3(aq)]>pH[NaClO(aq)]>pH[CH3COONa(aq)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息判断,下列选项不正确的是( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+ |
A. 第①组反应的其余产物为H2O和O2
B. 第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子 2 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com