合成氨对化学工业和国防工业具有重要意义.
(1)向合成塔中按1:4的物质的量之比充入N
2、H
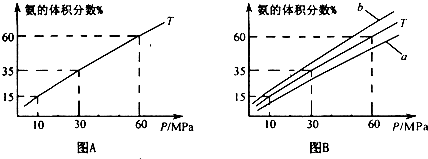
2进行氨的合成,图A为T
0C时平衡混合物中氨气的体积分数与压强(P)的关系图.
①写出工业上合成氨的化学方程式
.
②图A中氨气的体积分数为15.00%时,H
2的转化率=
24.45%
24.45%
.
③图B中T=500°C,温度为450
0C对应的曲线是
b
b
(选填字母“a“或“b”),选择的理由是
合成氨的正反应是放热反应,根据勒夏特列原理,其他条件不变,降低温度,化学平衡向放热反应方向移动
合成氨的正反应是放热反应,根据勒夏特列原理,其他条件不变,降低温度,化学平衡向放热反应方向移动
④由图象知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是
研制耐压设备(或增大压强的动力、材料的强度等其他合理答案)
研制耐压设备(或增大压强的动力、材料的强度等其他合理答案)
(写出一条即可).
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH
4(g)+H
2O

CO(g)+3H
2(g);△H=+QkJ/mol(Q>0)
(3)一定温度下,在2L容器中发生上述反应,各物质的物质的量变化如下表
| 时间/min |
CH4(mol) |
H20( mol) |
CO (mol) |
H2 (mol) |
| 0 |
0.40 |
1.00 |
0 |
0 |
| 5 |
X1 |
X2 |
X3 |
0.60 |
| 7 |
Y1 |
Y2 |
0.20 |
Y3 |
| 10 |
0.21 |
0.81 |
0.19 |
0.62 |
①分析表中数据,判断5?7min之间反应是否处于平衡状态
是
是
(填“是”或“否”),
前5min平均反应速率v(CH
4)=
0.02mol?min-1
0.02mol?min-1
.
②反应在7~10min之间,CO的物质的量减少的原因可能是
d
d
(填字母).
a?减少CH
4 b?降低温度c?增大压强d?充入H
2③若保持温度不变,向1L容器中起始充入0.15mol CH
4.0.45mol H
2O.
0.05
0.05
mol CO、
0.15
0.15
mol H
2,达到平衡时CH
4的体积百分含量与第一次投料相同.

 名校课堂系列答案
名校课堂系列答案
 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)