
面对能源与环境等问题,全球大力发展新能源的同时,还倡导节能减排、低碳经济。请回答下列问题:
Ⅰ、氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: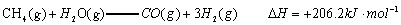
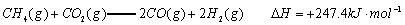
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。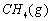 与
与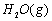 反应生成CO2(g)和
反应生成CO2(g)和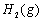 的热化学方程式为 。
的热化学方程式为 。
(2)电解尿素CO(NH2)2的碱性溶液制氢的装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。
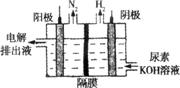 (3)
(3)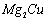 是一种储氢合金。350℃时,
是一种储氢合金。350℃时,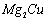 与
与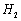 反
反
应,生成MgCu2和仅含一种金属元素的氢化物(其中
氢的质量分数为0.077)。则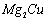 与
与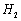 反应的化学
反应的化学
方程式为 。
 Ⅱ、碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生可逆反应:
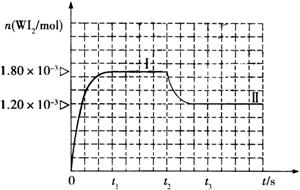
Ⅱ、碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生可逆反应: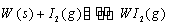 。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的
。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的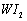 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象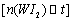 ,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
(4)该反应是 (填写“放热”或“吸
热”)反应。在450℃时,该反应的平
衡常数K= 。
(5)若保持450℃温度不变,向该容器中再加入0.508 g碘,当再次达到平衡时,反应混合气体中I2的百分含量 (填“变大”、“不变”或“变小”)。
(6)若保持450℃温度不变,向该容器中再加入0.002 mol W、0.000 6 mol I2、0.0054 mol WI2,则化学平衡 (填“正向移动”、“不移动”或“逆向移动”)。
【知识点】盖斯定律、电化学原理、化学平衡的综合应用
【答案解析】(1)CH4(g)+2H2O(g)== CO2(g)+4H2(g)△H=+165.0kJ·mol-1(2分)
(2)CO(NH2)2+8OH--6e-===CO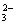 +N2↑+6H2O(2分)
+N2↑+6H2O(2分)
(3)2Mg2Cu+3H2 MgCu2+3MgH2(2分)
MgCu2+3MgH2(2分)
(4)放热(2分) 9(2分) (5)不变(2分) (6)不移动(2分)
解析::(1)①CH4(g)+H2O(g)═CO (g)+3H2(g)△H=+206.2kJ•mol-1,
②CH4(g)+CO2(g)═2CO (g)+2H2(g)△H=+247.4kJ•mol-1,
由盖斯定律可知,①×2-②可得CH4(g)+2H2O(g)═CO2(g)+4H2(g),
其反应热△H=(+206.2kJ•mol-1)×2-(+247.4kJ•mol-1)=+165.0 kJ•mol-1,
即热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ•mol-1,
由阳极排出液中含有大量的碳酸盐成份,尿素在阳极参与反应,则阳极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O;
令金属氢化物为RHx,金属R的相对分子质量为a,则x/(a+x)=0.77即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2,故反应方程式为:2Mg2Cu+3H2 MgCu2+3MgH2;
MgCu2+3MgH2;
升高温度,化学平衡向吸热方向移动;升高温度时,WI2的物质的量减少,所以该反应向逆反应方向移动,即逆反应是吸热反应,所以正反应是放热反应;反应开始时,碘的物质的量为n=0.508g÷254g/mol=0.002mol,反应达平衡时生成WI2,需要碘1.80×10-3mol参加反应,剩余碘0.0002mol,所以平衡时,c(WI2)=1.80×10−3mol÷0.05L=3.6×10-2mol/L,c(I2)=0.0002mol÷0.05L=0.004mol/L,K=0.036mol/L÷0.004mol/l=9
该反应是等体反应,假设两个相同的容器达平衡时百分含量相等,温度不变压入同一容器中,增大压强,平衡不移动,故反应混合气体中I2的百分含量不变。
综上,原平衡时,c(WI2)=3.6×10-2mol/L,c(I2)=0.004mol/L,温度不变,向该容器中再加入0.002 mol W、0.000 6 mol I2、0.0054 mol WI2,则c(WI2)=0.144mol/L,c(I2)=0.016mol/L,Qc=0.144mol/L÷0.016mol/L=9,故平衡不移动。
【思路点拨】本题考查盖斯定律、原电池的工作原理,学生应学会利用习题中的信息结合所学的知识来解答,掌握平衡常数、平衡移动的影响因素,注意对高考热点的训练。


科目:高中化学 来源: 题型:
下列溶液中物质的量浓度为1 mol·L-1的是( )。
A.将40 g NaOH固体溶解于1L水中
B.将22.4 L氯化氢气体溶于水配成1L溶液
C.将1L 10 mol·L-1的浓盐酸与9 L水混合
D.10 g NaOH固体溶解在水中配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.标准状况下,11.2 L NH3溶于1 L水,溶液中含有N原子的微粒总数为0.6NA
B.1.00 mol NaCl中,所有Na+的最外层电子总数约为8×6.02×1023
C.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
D.1mol FeCl3完全转化为Fe(OH)3胶体后形成NA个胶粒.
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
|

(1)该浓盐酸中HCl的物质的量浓度为______mol/L。
现在需要475 mL物质的量浓度为0.6 mol/L稀盐酸,用上述浓盐酸和蒸馏水配制:
(2)需要量取________ mL上述浓盐酸进行配制。
(3)配制过程中,除需使用烧杯、量筒、玻璃棒外,还需要的仪器是 、 。
(4)配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次)___________
A.用30mL蒸馏水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入所选用的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加蒸馏水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻线1—2cm处
(5)在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是________
A.摇匀后静置,发现液面低于刻线,未做任何处理
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.用量筒量取浓盐酸时俯视刻线
D.在配制前用已知浓度的稀盐酸润洗容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
关于某有机物 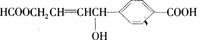 的性质叙述正确的是 ( )
的性质叙述正确的是 ( )
A、1 mol该有机物可以与3 mol Na发生反应、
B、1 mol该有机物可以与3 mol NaOH发生反应
C、1 mol该有机物可以与6 mol H2发生加成反应
D、1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学反应的认识正确的是( )
A.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
B.如果某化学反应的ΔH和ΔS均小于0,则反应一定能自发进行
C.化学反应过程中,一定有化学键的断裂和形成
D.反应物的总焓大于生成物的总焓时,ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是 ( )
A.锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快产生气泡的速率
B.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
C.电镀时,应把镀件置于电解槽的阴极
D.钢铁表面常易锈蚀生成Fe2O3·nH2O
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列各溶液中,离子一定能大量共存的是 ( )
A.强碱性溶液中:K+、Al3+、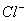 、
、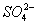
B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、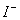 、
、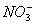
C.含有0.1 mol·L-1Ca2+溶液在中:Na+、K+、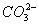 、
、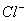
D.室温下,pH=1的溶液中: Na+、Fe3+、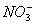 、
、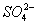
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,Na2CO3溶液存在水解平衡:
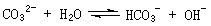 。下列说法正确的是
。下列说法正确的是
A. 稀释溶液,水解平衡常数增大 B. 通入CO2,平衡朝正反应方向移动
C. 升高温度, 减小 D. 加入NaOH固体,溶液PH减小
减小 D. 加入NaOH固体,溶液PH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com