
【题目】![]() 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是![]()
![]()
A.![]() 葡萄糖和
葡萄糖和![]() 果糖的混合物中羟基数目为
果糖的混合物中羟基数目为![]()
B.标准状况下,![]() 一氟甲烷中H原子数目为
一氟甲烷中H原子数目为![]()
C.![]() 溶液中离子总数大于
溶液中离子总数大于![]()
D.![]() 在稀硫酸作用下水解生成乙醇分子数目为
在稀硫酸作用下水解生成乙醇分子数目为![]()
【答案】D
【解析】
A.葡萄糖、果糖的相对分子质量都是180,且分子中都含5个羟基,12.0g葡萄糖和6.0g果糖的混合物的物质的量n=![]() =
=![]() =
=![]() ,则混合物中羟基数目为
,则混合物中羟基数目为![]() ,A正确;
,A正确;
B.一氟甲烷在标准状况下呈气态且一个分子中含有3个H原子,2.24L一氟甲烷物质的量n=![]() =
=![]() =
=![]() ,含H原子数目为
,含H原子数目为![]() ,B正确;
,B正确;
C.1L0.1mol/L(NH4)2HPO4溶液中溶质物质的量n=cV=0.1mol/L×1L=0.1mol,溶液中存在NH4++H2ONH3·H2O+H+,HPO42-+H2OH2PO4-+OH-,HPO42-H++PO43-,如果不考虑水解和电离,1mol![]() 水解和电离使溶液中离子总数增大,大于
水解和电离使溶液中离子总数增大,大于![]() ,C正确;
,C正确;
D.乙酸乙酯在酸性条件下的水解为可逆反应,1mol乙酸乙酯在稀硫酸作用下水解生成乙醇分子数目小于NA,D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】X、Y都是芳香族化合物,均为常见食用香精,广泛用于化妆品、糖果及调味品中。1 molX水解得到1 mol Y和1 mol CH3CH2OH,X、Y的分子量都不超过200,完全燃烧都只生成CO2和H2O。且X分子中碳和氢元素总的质量百分含量约为81.8%。
(1) X、Y分子量之差为___________________。
(2)1个Y分子中应该有____________个氧原子。
(3) X的分子式是_____________________________________。
(4) G和X互为同分异构体,且具有相同的官能团,用芳香烃A合成G路线如下:
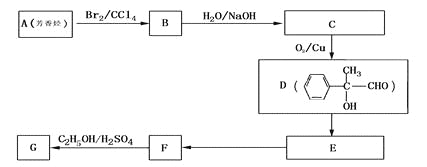
①写出A的结构简式____________________
② E→F的反应类型是_________反应,该反应的化学方程式为:____________________。
③写出所有符合下列条件的F的同分异构体的结构简式:
ⅰ.分子内除了苯环无其他环状结构,且苯环上有2个对位取代基。
ⅱ.一定条件下,该物质既能与银氨溶液发生银镜反应又能和FeCl3溶液发生显色反应。
______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 1 mol SiO2晶体中,含有 SiO键的数目为2 NA
B. 16.8 g铁粉与足量高温水蒸气反应,转移电子数为0.8 NA
C. 1 mol·L1AlCl3溶液中,含有Cl的数目为3 NA
D. 18 g D2O和H2O的混合物中,含有的中子数为9 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应的各物质浓度数据如下:
aA(g)+bB(g)![]() 2C(g)
2C(g)
起始浓度(mol·L-1) 3.0 1.0 0
2 s末浓度(mol·L-1) 1.8 0.6 0.8
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是( )
A. 9∶3∶4B. 3∶1∶2C. 2∶1∶3D. 3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入___________调至溶液pH=4,使Fe3+转化为Fe(OH) 3沉淀,此时溶液中的c(Fe3+)=_____________。
(2)过滤后,将所得滤液经过________,________操作,可得到CuCl2·2H2O晶体。
(3)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要进行的操作是________________。
(4)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。过滤后,滤液用0.1000 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL。(已知:I2+2S2O32-=S4O32-+2I-)。
①可选用________作滴定指示剂,滴定终点的现象是__________________________。
②CuCl2溶液与KI反应的离子方程式为________________________________。
③该试样中CuCl2·2H2O的质量百分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
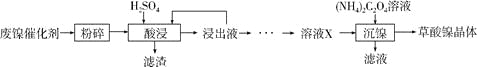
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Al3+ | 3.0 | 5.0 |
Ni2+ | 6.7 | 9.5 |
②Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9。
(1)“粉碎”的目的是____________。
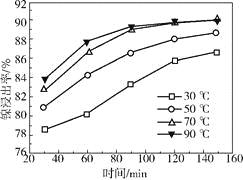
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如右图。“酸浸”的适宜温度与时间分别为_________(填字母)。
a.30℃、30min
b.90℃、150min
c.70℃、120min
d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是___________。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110 ℃下烘干,得草酸镍晶体。
①用乙醇洗涤的目的是_________________。
②烘干温度不超过110℃的原因是_________________。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,___,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步:___,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)。
②第2步中加入适量NH4F溶液的作用是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。
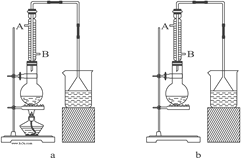
(2)反应装置中的烧瓶应选择下列哪种规格最合适(_____)
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是(_____)
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同物质的量浓度的 HC1 溶液,分别滴定物质的量浓度均为 0.1 mol/L 的三种碱溶液,滴定 曲线如图所示。下列判断正确的是

A. 滴定前,三种碱溶液中水电离出的 c(H+)大小关系: DOH>BOH>AOH
B. pH= 7 时,c(A+)=c(B+)=c(D+)
C. 滴定至 P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
D. 当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com