
���� A�ǵ�5���ڢ�A��Ԫ�أ���AΪRb��B�ǵ�3����Ԫ�أ�����������Ϊ2����BΪMg������Ԫ��ԭ��������С�����˳����B��C��D��A��C��D���������ӷֱ�Ϊ2��7������C��D�������Ӿ�Ϊ18��Ӧ���ڵ������ڣ�����CΪZn��DΪBr���ݴ˴��⣮
��� �⣺A�ǵ�5���ڢ�A��Ԫ�أ���AΪRb��B�ǵ�3����Ԫ�أ�����������Ϊ2����BΪMg������Ԫ��ԭ��������С�����˳����B��C��D��A��C��D���������ӷֱ�Ϊ2��7������C��D�������Ӿ�Ϊ18��Ӧ���ڵ������ڣ�����CΪZn��DΪBr��
��1����������ķ�����֪��CԪ�ط���ΪZn��
�ʴ�Ϊ��Zn��
��2��AΪRb��BΪMg��A��BԪ������������Ӧ��ˮ���ﶼ�ʼ��ԣ�����卑Ľ�����ǿ��þ������Mg��OH��2�ļ�������RbOH��
�ʴ�Ϊ���Mg��OH��2��RbOH��
��3��AΪRb����������Ӳ㣬DΪBr�����ĸ����Ӳ㣬����ԭ�Ӱ뾶��СRb��Br��
�ʴ�Ϊ��Rb��Br��
��4��DΪBr��DԪ�ص�����������Ӧˮ����Ļ�ѧʽΪHBrO4���䵥���ڳ����³�Һ̬���ӷ�������ʵ���ҳ���������ɫ�Լ�ƿ�У�
�ʴ�Ϊ��HBrO4��Һ���أ�
���� ���⿼����λ�á��ṹ�����ʹ�ϵ��Ӧ�ã���Ŀ�ѶȲ����ƶϸ�Ԫ������Ϊ���ؼ���ע������Ԫ�����ڱ��ṹ��Ԫ�������ɵ����ݣ�������ػ���֪ʶ�Ŀ��飬������ѧ�����Ӧ�û���֪ʶ��������


 â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 L 0.1 mol•L-1�İ�ˮ�к��е�NH3•H2O������Ϊ0.1 NA | |
| B�� | ��⾫��ͭʱ����������������6.4 g�����·��ת�Ƶ�����Ϊ0.2 NA | |
| C�� | ��״���£�2.24 L�Ķ��ȼ����к��е�̼�ȹ��ۼ�����ĿΪ0.2 NA | |
| D�� | һ�������£�4.6 g NO2��N2O4��������к��е�Nԭ����ĿΪ0.1 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | Cu��Mg | B�� | Al��Fe | C�� | Zn��Fe | D�� | Al��Mg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ϊͬλ�� | B�� | ��������Ԫ�� | C�� | HD��H2���ǵ��� | D�� | ��������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | ʵ����� | ʵ����Ʒ |
| �� | ���ɺ������ջһ� |  |
| �� | ���������ܽ⡢���� |  �͢ٲ������������������ƣ� |
| �� | ������Һ�е�I-����Ӧ�����ӷ���ʽΪ��2I-+H2O2+2H+=I2+2H2O | 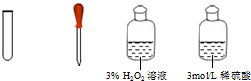 |
| �� | ȡ�������з�Ӧ����Һ���Թ��У���������CCl4�����ã��۲쵽���²���Һ��Ϊ�Ϻ�ɫ��˵�������к��е�Ԫ�أ� | 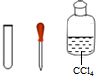 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���ۼ� | H-H | O=O | H-O |
| ����/kJ•mol-1 | 436 | 498 | X |
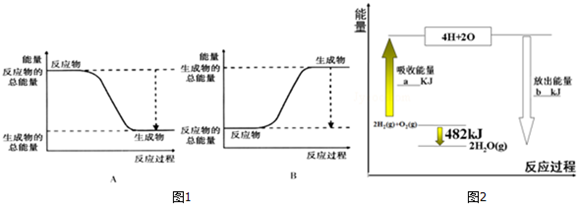
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | I-�Ļ�ԭ�Ա�Cl-ǿ | B�� | AgI���ܽ�ȱ�AgCl���ܽ�ȴ� | ||
| C�� | ����ᡢ�����Ϊǿ�� | D�� | AgI��AgCl������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 X��Y��Z���ֶ�����Ԫ�أ����ǵ�ԭ������֮��Ϊ16��ZԪ�ص�һ��ԭ�Ӻ��ڲ������ӣ�X��Y��Z����Ԫ�صij��������ڳ����¶�����ɫ����ζ���壬���ʵ������¿ɷ�����ͼ�仯��һ��B�����к��е�Zԭ�Ӹ�����C��������1����B��C���ַ����еĵ�����������10����ش��������⣺
X��Y��Z���ֶ�����Ԫ�أ����ǵ�ԭ������֮��Ϊ16��ZԪ�ص�һ��ԭ�Ӻ��ڲ������ӣ�X��Y��Z����Ԫ�صij��������ڳ����¶�����ɫ����ζ���壬���ʵ������¿ɷ�����ͼ�仯��һ��B�����к��е�Zԭ�Ӹ�����C��������1����B��C���ַ����еĵ�����������10����ش��������⣺ �� C������������ѧ���������Ǽ��Լ���C���ӵĿռ�ṹ�������Σ�
�� C������������ѧ���������Ǽ��Լ���C���ӵĿռ�ṹ�������Σ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.02 mol | B�� | 0.03mol | C�� | 0.04mol | D�� | 0.06mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com