
【题目】(227℃,1个大气压时),1.5L某烃蒸汽能在aL氧气中完全燃烧,体积增大到(a+3)L(相同条件下),问:
(1)该烃在组成上必须满足的基本条件是____________________
(2)当a=10L时,该烃可能的分子式__________________
(3)当该烃的分子式为C7H8时,a的取值范围为____________________
【答案】分子含氢原子为8 C4H8C3H8 a≥13.5
【解析】
(1)227℃时,生成的水为气态,根据烃燃烧通式:CxHy+(x+![]() )O2
)O2![]() xCO2+
xCO2+![]() H2O,利用气体体积差量计算;
H2O,利用气体体积差量计算;
(2)该烃完全燃烧,所以1.5(x+![]() )≤10,结合H原子数目,计算x的取值范围,结合C、H原子数目关系,据此书写可能分子式;
)≤10,结合H原子数目,计算x的取值范围,结合C、H原子数目关系,据此书写可能分子式;
(3)烃的分子式为C7H8,烃完全燃烧,则满足1.5(x+![]() )≤a,据此计算。
)≤a,据此计算。
(1)令烃的分子式为CxHy,则:
CxHy+(x+![]() )O2
)O2![]() xCO2+
xCO2+![]() H2O 气体体积差量△V
H2O 气体体积差量△V
1 (x+![]() -x-
-x-![]() -1)=
-1)=![]() -1
-1
1.5 (a+3-a-1.5)L=1.5L
所以![]() -1=1,解得y=8,即一个烃分子中氢原子数为8,且满足1.5(x+
-1=1,解得y=8,即一个烃分子中氢原子数为8,且满足1.5(x+![]() )≤a,即1.5(x+2)≤a,故答案为烃分子中氢原子数为8;(2)当a=10L时,该烃完全燃烧,所以1.5(x+
)≤a,即1.5(x+2)≤a,故答案为烃分子中氢原子数为8;(2)当a=10L时,该烃完全燃烧,所以1.5(x+![]() )≤10,即1.5×(x+2)≤10,解得x≤4.7,分子中H原子数目为8,所以该烃为C3H8或C4H8,故答案为C3H8或C4H8;(3)当该烃的分子式为C7H8时,烃完全燃烧1.5(x+
)≤10,即1.5×(x+2)≤10,解得x≤4.7,分子中H原子数目为8,所以该烃为C3H8或C4H8,故答案为C3H8或C4H8;(3)当该烃的分子式为C7H8时,烃完全燃烧1.5(x+![]() )≤a,即1.5×(7+2)≤a,解得a≥13.5。
)≤a,即1.5×(7+2)≤a,解得a≥13.5。


科目:高中化学 来源: 题型:
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径 (nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | 2 | 3 | 1 | 3 |
(1)⑧号元素的在周期表中的位置是________________;上述元素处于同一主族的有_________________。(用元素符号表示)
(2)上表中某两种元素形成的共价化合物中,每个原子都满足最外层为8电子的稳定结构,写出其电子式:_________________________(任写一种)。
(3)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式_____________________________________________________。
(4)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
![]() 和
和![]() 作核反应堆最佳热载体,
作核反应堆最佳热载体,![]() 和
和![]() 用作高温堆减速剂。下列说法正确的是________。
用作高温堆减速剂。下列说法正确的是________。
A.![]() 和
和![]() 互为同位素B.
互为同位素B.![]() 和
和![]() 属于同种核素
属于同种核素
C.![]() 和
和![]() 的化学性质不同D.
的化学性质不同D.![]() 和
和![]() 是同种物质
是同种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:

(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是_____(填标号)。
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为_________。
(3)过程③中,需加入的物质是__________。
(4)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2. 800 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3. 495 g。若该聚铁主要成分为[Fe(OH) (SO4)]n,则该聚铁样品中铁元素的质量分数为____________(假设杂质中不含铁元素和硫元素)。
(5)如图是将过程②产生的气体SO2转化为重要的化工原料H2SO4的原理示意图,若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: Fe3+、Mg2+、SCN 、Cl
B.![]() =1×10-12的溶液中:K+、Na+、CO32、NO3
=1×10-12的溶液中:K+、Na+、CO32、NO3
C.![]() 的溶液中: K+、NH4+、MnO4、SO42-
的溶液中: K+、NH4+、MnO4、SO42-
D.能使甲基橙变红的溶液中: Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
A. 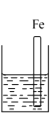 B.
B. 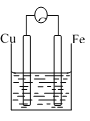 C.
C. 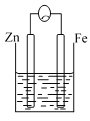
(1)A中反应的离子方程式为_____,B中Cu极电极反应式为______。
(2)C中被腐蚀的金属是____________,总反应方程式为____________,
(3)A、B、C中铁被腐蚀的速率,由大到小的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.苯佐卡因(![]() )是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
)是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
B.香叶醇( )能发生加成反应不能发生取代反应
)能发生加成反应不能发生取代反应
C.某有机物的分子式为C4H8,能使溴的CCl4溶液褪色,则它在一定条件下与水反应时最多可生成的有机物(不考虑立体异构)有4种
D.青蒿素(![]() )的一氯代物有5种(不含立体异构)
)的一氯代物有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
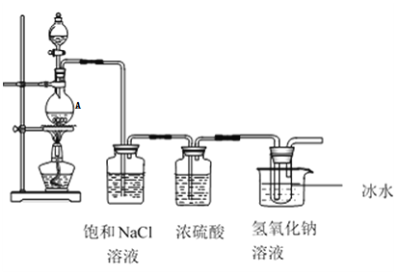
【题目】某研究小组为制备消毒液(主要成分是NaClO)设计了下列装置,并查阅下列资料:在温度较高情况下卤素单质和碱溶液能发生如下反应:3X2+6OH-![]() 5X-+XO3-+3H2O
5X-+XO3-+3H2O
回答下列问题:
(1)仪器 A的名称为_______发生装置中反应的离子方程式为:____。
(2)饱和NaCl溶液的作用是______,能否省去盛有浓硫酸的洗气瓶_____,理由是______
(3)能否省去冰水冷却________,用化学方程式表示原因是:_______,大试管内发生反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
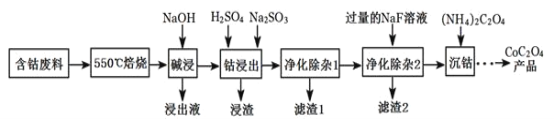
(1)“550℃煅烧”的目的是____。
(2)“浸出液”的主要成分是___。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为___。
(4)“净化除杂1”过程中,如何检验该杂质__(用离子方程式表示),现象为__:需在40~50℃加入H2O2溶液,其原因是__,目的是__(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是__。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5 mol/L,则滤液中c(Mg2+)为___mol/L。[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁![]() 去除水体中的硝酸盐
去除水体中的硝酸盐![]() 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.
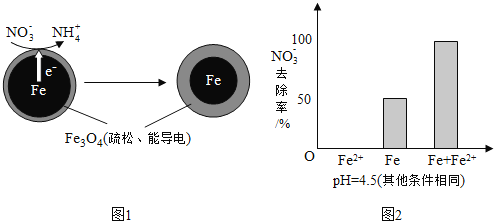
![]() 还原水体中
还原水体中![]() 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
![]() 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定![]() 的去除率和pH,结果如下:
的去除率和pH,结果如下:
初始pH |
|
|
| 接近 |
|
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
![]() 时,
时,![]() 的去除率低.其原因是______.
的去除率低.其原因是______.
![]() 实验发现:在初始
实验发现:在初始![]() 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的![]() 可以明显提高
可以明显提高![]() 的去除率.对
的去除率.对![]() 的作用提出两种假设:
的作用提出两种假设:
Ⅰ![]() 直接还原
直接还原![]() ;
;
Ⅱ![]() 破坏
破坏![]() 氧化层.
氧化层.
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实![]() 能与
能与![]() 反应生成
反应生成![]() 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入![]() 提高
提高![]() 去除率的原因:______.
去除率的原因:______.
![]() 其他条件与
其他条件与![]() 相同,经1小时测定
相同,经1小时测定![]() 的去除率和pH,结果如表:
的去除率和pH,结果如表:
初始pH |
|
|
| 约 | 约 |
1小时pH | 接近中性 | 接近中性 |
与![]() 中数据对比,解释
中数据对比,解释![]() 中初始pH不同时,
中初始pH不同时,![]() 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com