
| A. | 1molNH3和 1molHCl混合 | |
| B. | 1mol NO和 0.5 molO2混合 | |
| C. | 1molSO2和 1 molH2S混合 | |
| D. | 等体积的NO和NO2被足量烧碱溶液吸收 |
分析 A.氨气与HCl按照物质的量1:1恰好反应生成氯化铵;
B.NO与氧气按照2:1恰好反应生成二氧化氮气体;
C.根据反应方程式2H2S+SO2═3S↓+2H2O判断反应物过量情况;
D.等体积的NO和NO2恰好被氢氧化钠溶液吸收生成亚硝酸钠.
解答 解:A.1molNH3和 1molHCl混合,二者恰好反应生成1mol氯化铵,原来的气体均没有剩余,故A不选;
B.1mol NO和 0.5 molO2混合,二者恰好反应生成1mol二氧化氮气体,原来的气体均没有剩余,故B不选;
C.1molSO2和 1 molH2S混合,根据反应2H2S+SO2═3S↓+2H2O可知,1mol硫化氢完全反应消耗0.5mol二氧化硫,反应后剩余0.5mol二氧化硫,故C选;
D.等体积的NO和NO2被足量烧碱溶液吸收,发生反应为:NO+NO2+2NaOH═2NaNO2+H2O,根据反应可知原来的气体均没有剩余,故D不选;
故选C.
点评 本题考查了化学方程式的计算,题目难度不大,正确判断反应物过量情况为解答关键,注意掌握常见物质性质及发生反应原理,试题有利于提高学生的分析能力及灵活应用能力.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ①②③⑤ | C. | ②③④⑥ | D. | 以上全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 利用黄花蒿叶研究青蒿素结构的基本步骤为:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式 | |
| B. | 双氢青蒿素在水中的溶解性大于青蒿素 | |
| C. | ①、②的反应类型分别为还原反应、取代反应 | |
| D. | 青蒿素转化为双氢青蒿素,手性碳个数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 L 0.1 mol•L-1 (NH4)2Fe(SO4)2•6H2O溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH-)+c(SO42-) | |
| B. | 0.1 mol•L-1的NH4Cl与0.1 mol•L-1的NH3•H2O等体积混合:c(NH4+)+2c(H+)=c(NH3•H2O)+2c(OH-) | |
| C. | pH=9.4、浓度均为0.1 mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) | |
| D. | 0.1 mol•L-1 CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu→Cu2(OH)CO3 | B. | HCl→Cl2 | C. | Fe2O3→Fe | D. | Al(OH)3→Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | |
| C. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300 kJ•mol-1,有 NA个水分子生成且为 液体时,吸收1300 kJ的能量 | |
| D. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
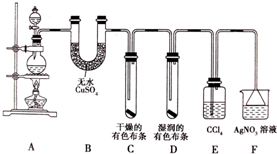 某化学实验兴趣小组为探究实验室制备Cl2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略):
某化学实验兴趣小组为探究实验室制备Cl2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com