

分析 (1)①2ZnS(s)+3O2(g)═2ZnO(s)+2SO2(g)△H1=-930kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H2=-221kJ•mol-1
③ZnO(s)+CO(g)═Zn(g)+CO2(g)△H3=198kJ•mol-1
将方程式$\frac{①+②}{2}$+③得ZnS(s)+C(s)+2O2(g)═Zn(g)+CO2(g)+SO2(g),焓变进行相应的改变;
当△G=△H-T△S<0时该反应一定能自发进行,该反应前后△S<0;
反应前后改变的物理量不变时,可逆反应达到平衡状态;
(2)①700℃~980℃时发生反应时,根据图知,生成ZnO、氧气和B,根据元素守恒知,B中含有S元素,因为生成氧气失电子,则S元素应该得电子发生还原反应,所以B应该是SO2,根据反应物和生成物及反应条件书写方程式;
②ZnFeO3.5和SO2在加热条件下生成ZnFeO4、S,电解硫酸锰时,生成二氧化锰和硫酸,阳极上失电子发生氧化反应.
解答 解:(1)①2ZnS(s)+3O2(g)═2ZnO(s)+2SO2(g)△H1=-930kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H2=-221kJ•mol-1
③ZnO(s)+CO(g)═Zn(g)+CO2(g)△H3=198kJ•mol-1
将方程式$\frac{①+②}{2}$+③得ZnS(s)+C(s)+2O2(g)═Zn(g)+CO2(g)+SO2(g),△H4=$\frac{(-930-221)kJ/mol}{2}$+198kJ/mol=-377.5kJ/mol;
当△G=△H-T△S<0时该反应一定能自发进行,该反应前后△S<0,则焓变应该小于0;
a.CO2与H2O(g)浓度相等,正逆反应速率不一定相等,所以不一定达到平衡状态,故错误;
b.该反应前后气体物质的量减少,当容器中气体的压强不再改变时正逆反应速率相等,反应达到平衡状态,故正确;
c.当v(NH3)正=2v(H2O)逆时该反应达到平衡状态,所以当2v(NH3)正=v(H2O)逆时该反应没有达到平衡状态,故错误;
d.反应前后问题密度改变,所以当容器中混合气体的密度不再改变时该反应达到平衡状态,故正确;
故答案为:-377.5;△H<0;bd;
(2)①700℃~980℃时发生反应时,根据图知,生成ZnO、氧气和B,根据元素守恒知,B中含有S元素,因为生成氧气失电子,则S元素应该得电子发生还原反应,所以B应该是SO2,根据反应物和生成物及反应条件书写方程式为2ZnSO4$\frac{\underline{\;700℃-980℃\;}}{\;}$2ZnO+2SO2↑+O2↑,故答案为:2ZnSO4$\frac{\underline{\;700℃-980℃\;}}{\;}$2ZnO+2SO2↑+O2↑;SO2;
②ZnFeO3.5和SO2在加热条件下生成ZnFeO4、S,反应方程式为4ZnFeO3.5+SO2$\frac{\underline{\;\;△\;\;}}{\;}$4ZnFeO4+S;
电解硫酸锰时,生成二氧化锰和硫酸,阳极上失电子发生氧化反应,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,
故答案为:4ZnFeO3.5+SO2$\frac{\underline{\;\;△\;\;}}{\;}$4ZnFeO4+S;Mn2+-2e-+2H2O=MnO2+4H+.
点评 本题考查电解原理、化学平衡状态判断、盖斯定律等知识点,侧重考查学生分析判断及计算能力,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,难点是电极反应式的书写,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 1mol NH4+和1mol OH-所含电子数均为10NA | |
| B. | 14gC2H4和14gC3H6 所含原子数均为3NA | |
| C. | 1L l mol/LH2SO4溶液与足量Zn充分反应生成22.4L H2 | |
| D. | 标准状况下,11.2LSO3所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34 | B. | 8.5 | C. | 17 | D. | 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
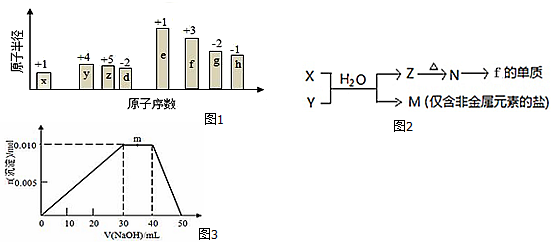
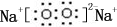 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥⑤④⑧⑦⑨ | B. | ①②⑤③⑥④⑧⑦⑨ | C. | ①②③④⑤⑧⑥⑦⑨ | D. | ①②③⑤⑥④⑧⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若I中装过量高锰酸钾溶液,Ⅱ中装澄清石灰水,则能检验SO2中是否混有CO2 | |
| B. | 若I中装足量澄清石灰水,Ⅱ中装浓硫酸,则能测定CO2和水蒸气的混合气体中水蒸气的含量 | |
| C. | 若I中装足量饱和碳酸钠溶液,Ⅱ中装浓硫酸,则能除去CO2中混有的HCl | |
| D. | 若I中装BaCl2溶液,Ⅱ中装水,则能证明SO2和NO2混合气体中SO2不与BaCl2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
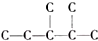 ,此烷烃的一溴代物有6 种,若此烷烃为炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH.
,此烷烃的一溴代物有6 种,若此烷烃为炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
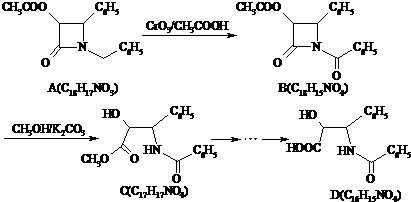
 .
.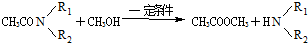
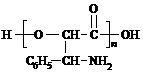 或
或 ;
;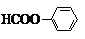 或
或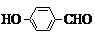 .
.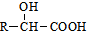 ②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl
②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl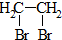
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com