
分析 (1)根据n=cV计算出硝酸的物质的量,然后根据反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O计算出消耗Cu的物质的量,再根据m=nM计算出铜的质量;
(2)稀硫酸足量,硝酸根离子会完全反应,根据反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O计算出0.08mol硝酸完全反应消耗Cu的物质的量,结合(1)可知还能够溶解铜的物质的量,再根据m=nM计算出还能溶解铜的质量;然后根据电子守恒计算出生成NO的物质的量,再根据V=nVm计算出生成气体在标准状况下的体积;
(3)设出Fe2+、Fe3+的物质的量都为n,然后利用电子守恒、质量守恒定律列式计算;
(4)反应有气体生成,且测得溶液中铁元素只以Fe2+形式存在,则固体和稀硝酸都没有剩余,反应后生成溶质为硝酸亚铁,生成气体为NO,根据质量守恒定律计算出硝酸亚铁中含有硝酸根离子的物质的量;亚铁离子完全沉淀时生成氢氧化亚铁,根据铁元素守恒可知硝酸根离子与氢氧根离子的物质的量相等,然后根据V=$\frac{n}{c}$计算出向反应后的溶液中加入0.1mol/L的NaOH溶液的体积.
解答 解:(1)100mL 0.8mol/L硝酸溶液中含有硝酸的物质的量为:0.8mol/L×0.1L=0.08mol,根据反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O可知,稀硝酸完全反应消耗Cu的物质的量为:0.08mol×$\frac{3}{8}$=0.03mol,则被溶解的铜的质量为:64g/mol×0.03mol=1.92g,
故答案为:1.92;
(2)根据反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O可知,氢离子足量时硝酸根离子会完全反应,则0.08mol NO3-完全反应消耗Cu的物质的量为:0.08mol×$\frac{3}{2}$=0.12mol,根据(1)可知已经消耗了0.03molCu,则还会溶解铜的物质的量为:0.12mol-0.03mol=0.09mol,还能溶解铜的质量为:64g/mol×0.09mol=5.76g;
根据电子守恒,0.09molCu完全反应生成NO的物质的量为:$\frac{0.09mol×2}{5-2}$=0.06mol,标准状况下0.06molNO的物质的量为:22.4L/mol×0.06mol=1.344L,
故答案为:5.76;1.344;
(3)100mL 0.8mol/L硝酸溶液中含有硝酸的物质的量为:0.8mol/L×0.1L=0.08mol,
若向100mL 0.8mol/L硝酸溶液中加入铁粉,测得反应后的溶液中Fe2+与Fe3+的浓度之比为1:1,设Fe2+、Fe3+的物质的量都为n,则加入铁的物质的量为2n,
根据电子守恒可知生成NO的物质的量为:$\frac{2n+3n}{5-2}$=$\frac{5}{3}$n,生成的硝酸铁、硝酸亚铁中含有硝酸根离子的物质的量为:0.08mol-$\frac{5}{3}$n,
根据质量守恒定律可知生成硝酸亚铁、硝酸铁的物质的量都是n,则2n+3n=0.08mol-$\frac{5}{3}$n,解得:n=0.012mol,
则加入铁的总物质的量为:0.012mol+0.012mol=0.024mol,质量为:56g/mol×0.024mol=1.344g,
故答案为:1.344;
(4)向100mL 0.8mol/L(0.08mol)硝酸溶液中加入一定量Fe、FeO、Fe2O3的混合物,充分反应后,放出气体224mL(标准状况下),该气体为NO,物质的量为:$\frac{0.224L}{22.4L/mol}$=0.01mol;
测得溶液中铁元素只以Fe2+形式存在,则反应生成硝酸亚铁,根据N原子守恒硝酸亚铁中含有硝酸根离子的物质的量为:0.08mol-0.01mol=0.07mol,
Fe2+完全沉淀时生成氢氧化亚铁,根据铁元素守恒可知硝酸亚铁与氢氧化亚铁的物质的量相等,则n(OH-)=n(NO3-)=0.07mol,
所以向反应后的溶液中加入0.1mol/L的NaOH溶液为:$\frac{0.07mol}{0.1mol/L}$=700mL,
故答案为:700.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题知识点较多、计算量较大,充分考查学生的分析、理解能力及化学计算能力.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:推断题

 、
、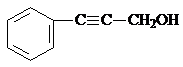 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应化学方程式为CO+H2O?CO2+H2 | |
| B. | 该反应为吸热反应 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 无论采取怎样的措施该体系中混合气体的平均分子量都不会发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水,乙醇和水,己烯和水 | |
| B. | 二溴乙烷和水,溴苯和水,硝基苯和水 | |
| C. | 己烷和水,乙醛和水,乙酸和乙醇 | |
| D. | 乙酸和水,甲苯和水,己烷和己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与Na2CO3溶液反应 | |
| C. | Y分子中所有原子可能在同一平面上 | |
| D. | Z能发生加成反应、取代反应,但不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe分别与氯气和稀盐酸反应所得氯化物不同 | |
| B. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 | |
| C. | SO2、NO2都能与水反应,其反应原理相同 | |
| D. | N2的化学性质通常非常稳定,但在放电条件下可以与O2反应生成NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯碱溶液洗涤沾有油污的器具 | |
| B. | 用食醋除去热水瓶胆中积存的水垢 | |
| C. | 用米汤检验加碘盐中含有碘 | |
| D. | 用灼烧并闻气味的方法区分化纤物质与纯毛织物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com