
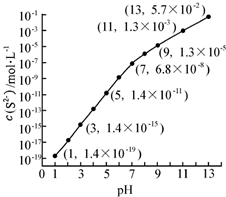
 (1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
(1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).分析 (1)硫化氢在溶液中为氢硫酸,氢硫酸为二元弱酸,电离分步进行;
(2)影响平衡移动的因素:浓度、同离子效应等,根据化学平衡移动原理来确定电离平衡的移动方向;
(3)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②pH=13时,c(H+)=10-13mol•L-1,根据硫化氢的电离平衡常数求出硫氢根离子的浓度,根据HS-?H++S2-结合 c (Na+)+c (H+)=c (OH-)+2c (S2-)+c (HS-)求解.
解答 解:(1)氢硫酸为二元弱酸,电离分步进行,电离方程式为H2S?H++HS-、HS-?H++S2-,故答案为:H2S?H++HS-、HS-?H++S2-;
(2)往硫化氢溶液中加入少量的盐酸,增大了氢离子浓度,会使平衡:H2S?H++HS-、HS-?H++S2-,逆向移动,即向左移动,
故答案为:左;
(3)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,
故答案为:5.7×10-2mol/L;0.043mol/L;
②pH=13时,c(H+)=10-13mol•L-1,K${\;}_{{a}_{1}}$=$\frac{C({H}^{+})C(H{S}^{-})}{C({H}_{2}S)}$=1.3×10-7,在硫化氢的一级电离中c(HS-)=$\frac{1.3×1{0}^{-7}mol/L×(0.1mol/L-C(H{S}^{-}))}{1{0}^{-13}}$≈0.1mol/L,在硫化氢的二级电离中,c (HS-)=0.1mol/L-c(S2-),c (Na+)+c (H+)=c (OH-)+2c (S2-)+c (HS-),则c(Na+)=c (OH-)+2c (S2-)+c (HS-)-c (H+)=0.1mol/L+2×5.7×10-2mol/L+c (HS-)-10-13mol•L-1=0.1mol/L+2×5.7×10-2mol/L+0.1mol/L-c(S2-)-10-13mol•L-1=0.257mol/L,
故答案为:0.257mol/L.
点评 本题考查了二元弱酸的电离、影响平衡移动的因素、离子浓度大小比较的应用等知识,注意元素守恒在离子浓度大小比较中的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24 L H2O中分子的数目为0.1 NA | |
| B. | 0.1 mol•L-1 NH4Cl溶液中含有Cl-的数目为0.1 NA | |
| C. | 常温下,1.7 g NH3中含有氢原子数目为0.3 NA | |
| D. | 5.6 g铁粉在足量的氯气中充分燃烧,转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表为某市售盐酸试剂瓶标签上的部分信息:
下表为某市售盐酸试剂瓶标签上的部分信息:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若pH>7,则一定是c1V1≥c2V2 | |
| B. | 在任何情况下都是c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| C. | 当醋酸和氢氧化钠溶液恰好完全反应后,滴加酚酞溶液,颜色变红 | |
| D. | 反应的离子方程式为:H++OH-═H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
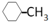 +H2
+H2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象及相关结论 |
| ①取少量电解质溶液于试管中,用pH试纸测其pH. | →试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH. |
| ②继续加入足量1mol•L-1HCl 溶液,再加入少量0.1mol•L-1BaCl2溶液,振荡. | →若有白色沉淀产生,则溶液中含有K2SO4. →若无白色沉淀产生,则溶液中没有K2SO4. |
| ③另取少量电解质溶液于试管中,先加1mol•L-1的H2SO4酸化,再滴入2~3滴0.01mol•L-1KMnO4酸性溶液,振荡. | →若KMnO4溶液紫红色褪去,则说明溶液中含有K2SO3,若KMnO4溶液紫红色不褪,则说明溶液不含K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

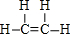 ;B的结构简式:CH3CH3;
;B的结构简式:CH3CH3;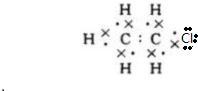 ;D的官能团名称羟基;G官能团的结构简式-COOH.
;D的官能团名称羟基;G官能团的结构简式-COOH.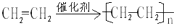 (反应类型加聚反应).
(反应类型加聚反应).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
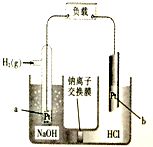
| A. | b极是负极 | |
| B. | a极电极反应式为H2-2e-═2H+ | |
| C. | 负载通过1mol电子,右池产生标况下5.6L气体 | |
| D. | 电池总反应式为:H++OH-═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com