
分析 (1)25℃时,0.1mol/L的H2A溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010,c(H+).c(OH-)=10-14,则溶液中c(H+)=0.01mol/L<0.1mol/L;H2A是弱电解质,加水稀释促进H2A电离,但H2A电离增大程度小于溶液体积增大程度,所以c(H+)、c(HA)、c(A-)都减小;
(2)在Na2A溶液中存在两步水解,以第一步水解为主,溶液显碱性.
解答 解:(1)25℃时,0.1mol/L的H2A溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010,c(H+).c(OH-)=10-14,则溶液中c(H+)=0.01mol/L<0.1mol/L;H2A是弱电解质,加水稀释促进H2A电离,但H2A电离增大程度小于溶液体积增大程度,所以c(H+)、c(HA-)、c(A2-)都减小;
A.加水稀释促进H2A电离,则$\frac{c({H}^{+})}{c({H}_{2}A)}$增大,故A正确;
B.$\frac{c(H{A}^{-})}{c({A}^{2-})×c({H}^{+})}$为常数,c(H+)减小,则$\frac{c(H{A}^{-})}{c({A}^{2-})}$ 减小,故B错误;
C.$\frac{c(H{A}^{-})}{c({H}_{2}A)•c(O{H}^{-})}$是HA-的水解常数的倒数,水解常数不变,所以$\frac{c(H{A}^{-})}{c({H}_{2}A)•c(O{H}^{-})}$不变,故C错误;
D.c(H+)减小,所以c(OH-)增大,故D正确;
故答案为:AD;
(2)在Na2A溶液中存在两步水解,以第一步水解为主,溶液显碱性,则溶液中离子浓度大小关系为:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);
故答案为:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+).
点评 本题考查电解质强弱判断、弱电解质电离,知道强弱电解质的本质区别,注意稀释弱电解质时并不是溶液中所有微粒浓度都减小,为易错点,题目难度中等,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B△H=+119kJ/mol,可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol | |
| D. | 在25℃、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则表示H2燃烧热的化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 热稳定性:Y的气态氢化物>Z的气态氢化物 | |
| B. | Z的最高价氧化物对应水化物的分子式为H2ZO4 | |
| C. | X元素的单质能与所有强酸发生反应放出H2 | |
| D. | R的核外电子数与OH-的核外电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
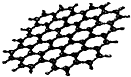 最近,科学家从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质.可以制成纳米材料.其结构如图所示:下列关于石墨烯的说法正确的是( )
最近,科学家从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质.可以制成纳米材料.其结构如图所示:下列关于石墨烯的说法正确的是( )| A. | 属于高分子化合物 | B. | 与金刚石互为同分异构体 | ||
| C. | 性质稳定不能与氧气等物质反应 | D. | 能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用化学反应可实现12C到14C的转化 | |
| B. | 天然气、煤气大量泄漏遇到明火会爆炸 | |
| C. | 大量使用燃煤发电是形成雾霾的主要原因 | |
| D. | 晶体硅可用作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| B. | 外电路中电子由c电极流向VB2电极 | |
| C. | 电解过程中,c电极表面先有红色物质析出,后有气泡产生 | |
| D. | 若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com