
【题目】(化学---选修3:物质结构与性质)“可燃冰”是蕴藏于海底的一种潜在能源。它由盛有甲烷、氮气、氧气、硫化氢等分子的水分子笼构成。
(1)水分子间通过______相互结合构成水分子笼。N、O、S元素第一电离能由大到小的顺序为________(填元素符号)。
(2)从海底取得的“多金属结核”样本,样本中含铁、锰等多种金属。
①基态铬原子的电子排布式为________________。
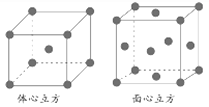
②金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:

①写出基态Cu2+的核外电子排布式_______。
②胆矾中含有的粒子间作用力是_______(填序号)。
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
③在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1 mol CN-中π键的数目为_______。
胆矾受热分解得到铜的某种氧化物,其晶胞结构如上图所示,则氧的配位数是_____。
【答案】氢键 N﹥O﹥S 【Ar】3d54s1 2 [Ar]3d9 a、b、d、e 1.204×1024 2
【解析】
(1)由于O的电负性特别大且原子半径较小,导致水分子之间能产生氢键,所以水分子间通过氢键相互结合构成水分子笼,同周期元素,从左到右,第一电离能逐渐增大,N原子的最外层P轨道有3个电子,处于半充满状态,稳定,第一电离能比相邻元素的第一电离能都大,同主族元素,从上到下,第一电离能逐渐减小,所以N、O、S元素第一电离能由大到小的顺序为N﹥O﹥S;
(2)铬是24号元素,根据基态原子的核外电子排布规则和洪特规则的补充说明,基态铬原子的电子排布式为【Ar】3d54s1;铁的面心立方晶胞中铁原子的个数为8×![]() +6×
+6×![]() =4,铁的体心立方晶胞中铁原子在个数为8×
=4,铁的体心立方晶胞中铁原子在个数为8×![]() +1=2,则实际含有的Fe原子个数之比为4:2=2;
+1=2,则实际含有的Fe原子个数之比为4:2=2;
(3)①铜为29号元素,根据基态原子的核外电子排布规则,电子排布式为[Ar]3d104s1,Cu2+的核外电子排布式为[Ar]3d9;
②根据胆矾的结构示意图可以看出,H2O与Cu之间为配位键,Cu2+与SO42-为离子键,水分子间有氢键,水分子、硫酸根内部为极性共价键,胆矾中含有的粒子间作用力有离子键、极性键、配位键、氢键,选a、b、d、e;
③CN-中C与N共用三对电子,一个σ键。二个π键,1 mol CN-中π键有2NA个(1.204×1024);图中可以看出,白色为Cu,黑色为O,则氧的配位数为2。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】室温时,配制一组c(H2A)+c(HA-)+c(A2-)=0.10mol·L-1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法中不正确的是
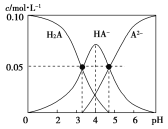
A.在c(Na+)=0.10mol·L-1的溶液中:c(H2A)-c(OH-)=c(A2-)-c(H+)
B.在pH=4的溶液中, c(HA-)=c(A2-) + c(H2A)
C.在pH=7的溶液中:c(Na+)=2c(A2-)
D.K1(H2A)的数量级约为10-3.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.CO、CO2的应用和治理是当今社会的热点问题。
CO工业上可用于高炉炼铁,发生如下反应: 1/3Fe2O3(s) + CO(g)![]() 2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的正反应为_____反应(填“放热”或“吸热”),欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是____(选填序号)
a.及时吸收或移出CO2 b.增大反应体系的压强
c.用更高效的催化剂 d.粉碎矿石,增大接触面积
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时
FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时![]() 增大的是______(选填编号)。
增大的是______(选填编号)。
a.升高温度 b.增大压强
c.充入一定量CO d.再加入一些铁粉
II.合成尿素的反应为:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g)+Q(Q>0)。
CO(NH2)2(s)+H2O(g)+Q(Q>0)。
一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达到平衡,测得容器中CO2的浓度为0.05molL-1 。
完成下列填空:
(1)平均反应速率υ(NH3)=____________。
(2)下列描述中能说明上述反应已达平衡的是_________。(填序号)
a.2υ正(NH3)=υ逆(H2O) b.气体的平均相对分子质量不随时间而变化
c.NH3和CO2的比例保持不变 d.气体的压强不再发生变化
(3)为提高尿素的产率,工业上用该反应生产尿素时,合适的反应条件是_______。(填序号)
a.200℃ b.800℃ c.101 kPa d.24000 kPa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2O2和H2SO4的混合溶液可溶出印刷电路板中的铜,其热化学方程式为Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l) ΔH已知①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1=+64 kJ·mol-1②2H2O2(l)===2H2O(l)+O2(g) ΔH2=-196 kJ·mol-1③H2(g)+1/2O2(g)===H2O(l) ΔH3=-286kJ·mol-1。下列说法不正确的是
A. 反应①可通过铜作电极电解稀H2SO4的方法实现
B. 反应②在任何条件下都能自发进行
C. 若H2(g)+1/2O2(g)===H2O(g) ΔH4,则ΔH4<ΔH3
D. ΔH=-320 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是( )
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时v正(O2)=![]() v逆(NO)
v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
(1)基态N原子的价电子占据的能量最高的能级是___,价电子在该能级上的排布遵循的原则是__。
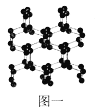
(2)除了已知的氮气,科学家还先后研究出了N4、N60、N70、高聚氮等物质。而高聚氮结构具有空间网状结构,如图一所示,则N70的沸点___![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 高聚氮的沸点,原因是___;
高聚氮的沸点,原因是___;
(3)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3)等。与全氮阴离子互为等电子体的一种非极性分子的结构式为___。叠氮化物能形成多种配合物,在[CO(N3)(NH3)5]SO4,其中钴原子的配体是___,SO42-的立体构型为___。
(4)HN3是一种全氮阴离子酸,可由肼(N2H4)被HNO2氧化制得。下列说法正确的是____。
A.酸性:HNO2>HNO3
B.N2H4分子中N原子均采取sp3杂化
C.NaN3的晶格能大于KN3的晶格能
D.纯叠氮酸HN3在常温下是一种液体,是因为分子中存在一种特殊的化学键-氢键
(5)N8是一种由全氮阳离子和全氮阴离子构成的特殊物质,已知阳离子由5个氮原子排列成V形,每个氮原子均达到8电子稳定结构,则阳离子的电子式为___。
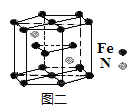
(6)一种氮铁化合物的结构如图二所示,若图中六棱柱的体积为Vcm3,用NA表示阿伏加德罗常数的值,则该晶体的密度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题:
(1)写出电子式NH4Cl _______ ,它的阳离子价层电子对对数为______,该离子空间构型为_______。
(2)周期表一共18列,第四周期第11列元素A,表示A所在族的符号为_________,它的基态原子结构示意图为_____,A+离子的价层电子排布图为____________,A2+离子的价层电子排布式为_____________,A+离子和A2+离子较稳定的是(填离子符号)_______,原因________________________。
(3)乙炔和乙烯分子,它们的σ键个数之比为______,乙烯分子中C原子杂化方式为________,C、N、O三种原子第一电离能从大到小排列____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应:3A(g)+2B(g) ![]() xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
A. x=3B. B的转化率为20%
C. 平衡时气体压强是原来的0.94倍D. 达到平衡时A的浓度为1.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式:____________________________________________
能说明醋酸是弱电解质的事实是_____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com