
| A. | 铝土矿(Al2O3) | B. | 磁性氧化铁(FeO) | ||
| C. | 铁红(Fe2O3) | D. | 明矾[KAl(SO4)2•12H2O] |
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
氧化还原反应与生产、生活、科技密切相关,请回答下列问题:
(1)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于__________腐蚀
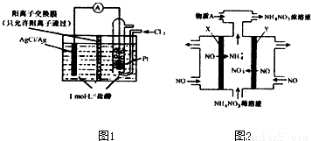
(2)如图1所示的原电池装置中,负极的电极反应为_________________;H+的移动方向为_____________电池总反应方程式为_________________当电路中转移0.1mole-时,交换膜左侧溶液中减少的质量为_____________.
(3)电解NO制备NH4NO3原理如图2所示,接电源正极的电极为___________(填X或Y),X电极反应式为_____________为使电解产物完全转化为NH4NO3,需要补充的物质A的化学式为_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 原物质 | 所含杂质 | 除杂试剂 | 主要操作方法 | |
| A | HNO3溶液 | H2SO4 | BaCl2溶液 | 过滤 |
| B | CO2 | SO2 | 酸性KMnO4溶液、浓硫酸 | 洗气、干燥 |
| C | SiO2 | Al2O3 | 稀盐酸 | 过滤 |
| D | C2H5OH | CH3COOH | CaO | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
2H2(g)+O2(g)═2H2O(g)△H2
C(s)+O2(g)═CO2(g)△H3
则反应12CO2(g)+10H2O(g)+O2(g)+6N2(g)═4C3H5(ONO2)3(l)的△H为( )
A.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
C.12△H3-5△H2-2△H1 D.△H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:

已知碳的燃烧热△H1=akJ·mol—1
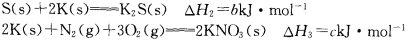
则x为
A.a+b-c B.c+3a-b C.3a+b-c D.c+a-b
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 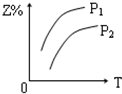 | B. | 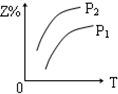 | C. | 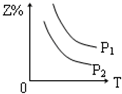 | D. | 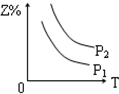 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com