
下列说法中正确的是
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1 mol•L-1氨水中加入少量水,pH减小,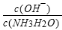 减小
减小
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:2015-2016学年西藏日喀则一中高二月考化学试卷(解析版) 题型:选择题
CH4与Cl2在光照条件下反应生成多种产物,其中物质的量最大的是
A.HCl B.CCl4 C.CH3Cl D.H2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二下期末化学试卷(解析版) 题型:选择题
下列根据有关“规律”推出的结论合理的是
A. 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B. 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C. 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性
D. 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二下期末化学试卷(解析版) 题型:选择题
下列电子排布中,原子处于激发状态的是
A. 1s22s22p5
B. 1s22s22p43s2
C. 1s22s22p63s23p63d54s1
D. 1s22s22p63s23p63d34s2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南株洲二中等六校高二下期末化学试卷(解析版) 题型:填空题
A、B、C、D、E均为可溶于水的固体,组成它们的离子有
阳离子 | Na+、Mg2+、Al3+、Ba2+、Fe3+ |
阴离子 | OH-、Cl-、CO32-、SO42-、HSO4- |
分别取它们的水溶液进行实验.结果如下:
①A溶液与C溶液反应既生成白色沉淀又有气体生成,沉淀可溶于B溶液;
②A溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失;
③B溶液中加少量D溶液反应有白色沉淀生成,此沉淀不溶于盐酸;
④C溶液与D溶液反应生白色沉淀,沉淀可溶于盐酸;
⑤D溶液与E溶液反应生成红褐色沉淀,沉淀可溶于B溶液;
据此回答下列问题
(1)B________;C________;E________;
(2)写出A与过量D溶液反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南株洲二中等六校高二下期末化学试卷(解析版) 题型:选择题
设NA为阿伏加罗常数的数值,下列说法正确的是
A.一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA
B.5.6g铁粉与足量水蒸汽反应生成的H2分子数目为0.1NA
C.向0.1mol/L的FeBr2溶液中通适量Cl2,当c(Br-)=0.1mol/L时,消耗Cl2的分子数为0.1NA
D.在反应Cu2S+O2 2Cu+SO2中,每生成1molCu,转移电子数目为2NA
2Cu+SO2中,每生成1molCu,转移电子数目为2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二下期末模拟化学试卷(解析版) 题型:实验题
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程。
请你参与并协助他们完成相关学习任务.
该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定.学习小组的同学设计了滴定的方法测定x值.
①称取2.520g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4.
③用浓度为0.1000mol•L-1的KMnO4标准溶液进行滴定,达到终点时消耗20.00mL.
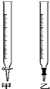
(1)滴定时,将酸性KMnO4标准液装在如图中的_______(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是________________;
(3)通过上述数据,求得x=______;
讨论:①若滴定终点时仰视滴定管刻度,则由此测得的x值会______(填“偏大”、“偏小”或“不变”,下同);
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北保定一中高二下期末化学试卷(解析版) 题型:填空题
FeCl3是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的aL氯化氢气体溶于100g水中,得到的盐酸的密度为bg•mL-1,则该盐酸的物质的量的浓度是______________________________;
(2)向100mL的FeBr2溶液中通入标准状况下Cl23.36L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为______________________________;
(3)FeCl3溶液可以用来净水,其净水的原理为________________________(用离子方程式表示),若用100mL2mol•L-1的FeCl3溶液净水时,生成具有净水作用的微粒数__________0.2NA(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西西北大学附中高二下期末化学试卷(解析版) 题型:选择题
下列叙述正确的是 ( )
A.1个甘氨酸分子中存在9对共用电子对(甘氨酸的结构简式为NH2—CH2—COOH)
B.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
C.H2S和CS2分子都是含极性键的极性分子
D.正四面体分子中键角可能是109°28′或60o
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com