
下列关于甲、乙、丙、丁四个图象的说法中,正确的是( )
|
| A. |
是等质量的两份锌粉a、b分别加到过量的稀硫酸中,同时向a中加入少量CH3COONa溶液,产生H2的体积V(L)与时间t(min)的关系图 |
|
| B. |
足量CO2不断通入含KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的体积的关系图 |
|
| C. |
由图可知,双氧水在有催化剂存在时的热化学方程式为:2H2O2(l)=2H2O(l)+O2(g)△H=﹣2(Ea2′﹣Ea2) kJ•mol﹣1 |
|
| D. |
装置图能实现铁上镀锌 |
| 化学反应速率的影响因素;热化学方程式;电解原理;有关混合物反应的计算. | |
| 分析: | A、向稀硫酸中加入少量CH3COONa溶液,产生氢气的速率减慢; B、只要通入CO2,立刻就有沉淀BaCO3产生;将Ba(OH)2消耗完毕,接下来消耗KOH,因而此段不会产生沉淀(即沉淀的量保持不变);KOH被消耗完毕,接下来消耗KAlO2,有Al(OH)3沉淀生成;又因二氧化碳足量,还可以继续与上面反应的产物K2CO3、BaCO3反应,据此进行判断; C、催化剂通过降低反应的活化能加快反应速率,不影响焓变大小; D、铁上镀锌,铁作阴极. |
| 解答: | 解:A、向稀硫酸中加入少量CH3COONa溶液,产生氢气的速率减慢,产生氢气的总量相同,故A错误; B、CO2先与Ba(OH)2反应(有沉淀BaCO3生成),当Ba(OH)2消耗完毕后再与KOH反应(此时无沉淀);最后与KAlO2反应(有沉淀Al(OH)3生成),以上过程中图形应是:出现沉淀(BaCO3),平台,沉淀增加[因有Al(OH)3生成];过量的CO2还可以继续与K2CO3反应得到KHCO3,继续过量的CO2还可以使BaCO3沉淀溶解,最后是Al(OH)3沉淀,所以接着的图形应该为:平台,沉淀(BaCO3)减少,平台,故整个过程的图形应为:出现沉淀(BaCO3),平台,沉淀增加[因有Al(OH)3生成],平台,沉淀(BaCO3)减少,平台,故B错误; C、催化剂通过降低反应的活化能加快反应速率,不影响焓变大小,故C正确; D、铁上镀锌,铁作阴极,锌作阳极,故D错误; 故选C. |
| 点评: | 本题考查了影响反应速率的因素、沉淀的生成和溶解图象、催化剂的催化原理、电镀原理,题目难度中等. |


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
有如下3个实验:
| 实验1 | 将金属X与金属Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
| 实验2 | 将片状的金属X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈 |
| 实验3 | 用惰性电极电解等物质的量浓度的Y和金属Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
依据上述实验现象,下列推测中正确的是 ( )
A.金属的活动性顺序:Y>Z>X>W
B.实验1中,Y作正极
C.Z放入CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸可构成原电池,X作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍.下列说法正确的是( )
|
| A. | R的原子半径比Z的大 |
|
| B. | R的氢化物的热稳定性比W的强 |
|
| C. | X与Y形成的化合物只有一种 |
|
| D. | Y的最高价氧化物的水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
材料的不断发展可以促进社会进步.
①“玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中使用了镁铝合金,选用镁铝合金的优点是 、、 (任答一点).
②碳化硅硬度很大,它属于 (填字母).
a.金属材料 b.无机非金属材料 c.有机高分子材料
③随便丢弃用过的聚乙烯塑料膜会造成白色污染,写出由乙烯在催化剂作用下制备聚乙烯的化学方程式 .

查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题:
(1)①反应Cl2+H2O⇌H++Clˉ+HClO其化学平衡常数K的表达式为:
②在25℃下,将a mol•L﹣1的氨水与0.01mol•L﹣1的盐酸等体积混合,反应平衡时溶液中c(NH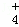 )=c(Cl﹣),试用含a的代数式表示NH3•H2O的电离常数Kb= .
)=c(Cl﹣),试用含a的代数式表示NH3•H2O的电离常数Kb= .
(2)常温下,向一定体积的0.1mol•L﹣1醋酸溶液中加水稀释后,下列说法正确的是 .
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中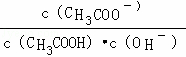 不变
不变
D.溶液中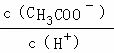 减小
减小
(3)①常温下将0.15mol•L﹣1的稀硫酸V1 mL与0.1mol•L﹣1的NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2= (溶液体积的变化忽略不计,硫酸电离方程式:H2SO4=2H++SO42﹣).
②常温下将pH=3的醋酸溶液V1 mL与pH=11的NaOH溶液V2 mL混合,则下列说法正确的是 .
A.若混合后溶液呈中性,则c(H+)+c(OH﹣)=2×10﹣7 mol•L﹣1
B.若V1=V2,混合后溶液的pH一定等于 7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
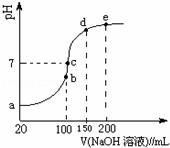
(4)NH4HSO4在分析试剂、医药、电子工业中用途广泛.现向100mL 0.1mol•L﹣1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.试分析图中a~e 5个点,回答下列问题:
①水的电离程度最大的是 点;
②在c点,溶液中各离子浓度由大到小的排列顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
卤素互化物与卤素单质性质相似。已知CH2=CH—CH=CH2(1,3—丁二烯)与氯气发生加成产物有三种:
① CH2Cl—CHCl—CH=CH2 (1,2—加成)
② CH2Cl—CH=CH—CH2Cl (1,4—加成)
③ CH2Cl—CHCl—CHCl—CH2Cl(完全加成)
据此推测CH2=C(CH3)—CH=CH2(异戊二烯)与卤素互化物BrCl的加成产物有几种(不考虑顺反异构和镜像异构( )
A.6种 B.10种 C.12种 D.14种
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为2 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-746.4 kJ·mol-1。起始反应时NO和CO各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) ΔH=-746.4 kJ·mol-1。起始反应时NO和CO各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A.反应前5秒钟内,用NO表示的平均反应速率为0.1 mol·L-1·s-1
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2)
D.保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO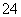
B.甲基橙呈红色的溶液:NH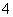 、Ba2+、AlO
、Ba2+、AlO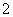 、Cl-
、Cl-
C.与铝反应产生大量氢气的溶液:Na+、K+、CO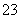 、Cl-
、Cl-
D.pH=12的溶液:K+、Na+、CH3COO-、Br-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com