
分析 X、Y是短周期元素,且X的原子序数比Y大4.
I.若X是金属元素,Y是非金属元素,化合物XY是优质的耐高温材料,则X为Mg、Y为O;
II.若X是短周期最活泼的金属元素,则X为Na,Y为N.
(3)N2H4、O2与NaOH溶液组成的电池,负极发生氧化反应,N2H4在负极失去电子,生成氮气与水;原电池电解质溶液中阴离子向负极移动,阳离子向正极移动;
(4)一水合氨与硫酸反应生成硫酸铵,溶液中离子浓度增大;等体积混合后溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol/L,硫酸根为0.005mol/L,根据电荷守恒计算c(NH4+),再根据物料守恒(N元素守恒)计算溶液中c(NH3.H2O),代入Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$计算.
解答 解:X、Y是短周期元素,且X的原子序数比Y大4.
I.若X是金属元素,Y是非金属元素,化合物XY是优质的耐高温材料,则X为Mg、Y为O.
(1)元素Y为氧,在元素周期表的位置为:第二周期VIA族,故答案为:第二周期VIA族;
(2)氧气、二氧化碳、氮气都能与Mg蒸气反应,可以用氩气作为冷却气体,故答案为:D;
II.若X是短周期最活泼的金属元素,则X为Na,Y为N.
(3)N2H4、O2与NaOH溶液组成的电池,负极发生氧化反应,N2H4在负极失去电子,生成氮气与水,负极电极反应式为:N2H4+4OH-+4e-=N2+4H2O;原电池中OH-移向负极,
故答案为:N2H4+4OH-+4e-=N2+4H2O;负;
(4)一水合氨与硫酸反应生成硫酸铵,溶液中离子浓度增大,滴加过程中溶液的导电能力增强,
等体积混合后溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol/L,硫酸根为0.005mol/L,根据电荷守恒:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),则c(NH4+)=2c(SO42-)=0.01mol/L,根据物料守恒(N元素守恒):c(NH4+)+c(NH3.H2O)=0.5a mol/L,则c(NH3.H2O)=(0.5a-0.01)mol/L,故电离平衡常数Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{0.01×1{0}^{-7}}{(0.5a-0.01)}$=$\frac{2}{a-0.02}$×10-9,
故答案为:增强;$\frac{2}{a-0.02}$×10-9.
点评 本题比较综合,涉及元素推断、原电池、电离平衡常数计算等,(4)中关键是利用电荷守恒与物料守恒计算离子浓度,是对基础知识与学生综合能力的考查.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物都可以与强碱溶液反应 | |
| B. | 与水反应生成酸的氧化物都是酸性氧化物 | |
| C. | 金属氧化物都是碱性氧化物或两性氧化物 | |
| D. | 不能与酸反应的氧化物一定能与碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
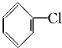 制取
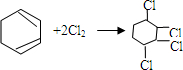
制取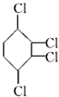 ,其合成流程如下:
,其合成流程如下:
 .
. ,
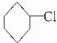
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
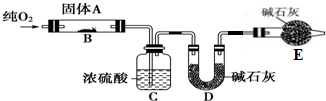
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
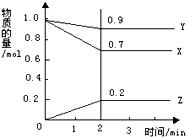 某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min).
某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com