
 .
.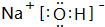 或
或 等,一种共价化合物的电子式为
等,一种共价化合物的电子式为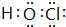 等.
等. 分析 短周期元素中,D元素原子核外M电子层与K电子层上的电子数相等,则D为Mg;室温下E元素的单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,则E是Al;A可分别与B、F形成A2B,A2B2、AF等共价化合物,F所形成的盐在海水中的含量仅次于海水中水的含量,则A为H元素、B为O元素、F为Cl,A分别与B、F形成H2O、H2O2、HCl;C可分别与B、F形成C2B、C2B2、CF等离子化合物,在C2B、C2B2、CF中C的化合价是+1价,C是钠元素,形成的化合物分别为Na2O、Na2O2、NaCl,据此解答.
解答 解:短周期元素中,D元素原子核外M电子层与K电子层上的电子数相等,则D为Mg;室温下E元素的单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,则E是Al;A可分别与B、F形成A2B,A2B2、AF等共价化合物且,F所形成的盐在海水中的含量仅次于海水中水的含量,则A为H元素、B为O元素、F为Cl,A分别与B、F形成H2O、H2O2、HCl;C可分别与B、F形成C2B、C2B2、CF等离子化合物,在C2B、C2B2、CF中C的化合价是+1价,C是钠元素,形成的化合物分别为Na2O、Na2O2、NaCl.
(1)D为Mg元素,位于周期表中第三周期ⅡA族;E为Al元素,原子结构示意图为  ,
,
故答案为:三、ⅡA; ;
;
(2)上述元素的单质可作自来水消毒剂的有:Cl2、O3,H2O与Mg单质共热的化学反应方程式:Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑,
故答案为:Cl2、O3;Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑;
(3)H、O、Na、Cl中的三种元素按原子个数比1:1:1可形成多种化合物,离子化合物有NaOH、NaClO等,电子式为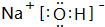 、
、 ,共价化合物有HClO等,电子式为
,共价化合物有HClO等,电子式为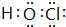 等,
等,
故答案为: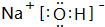 或
或 等;
等;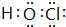 等.
等.
点评 本题考查元素化合物推断,注意根据D原子结构、E的性质、化合物类型与组成进行推断,侧重对化学用语的考查.


科目:高中化学 来源: 题型:选择题
| M组 | N组 | |
| A | H-I键键能大于H-Cl键键能 | HI比HCl稳定 |
| B | HI分子间作用力小于HCl分子间作用力 | HCl比HI稳定 |
| C | HI分子间作用力大于HCl分子间作用力 | HI的沸点比HCl高 |
| D | H-I键键能小于H-Cl键键能 | HI的沸点比HCl高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加H2的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 压强不变,充入氮气使容器体积增大 | |
| D. | 体积不变,充入氮气使容器压强增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl溶于水和NaCl溶于水 | B. | 干冰升华和碘升华 | ||
| C. | NH4Cl受热分解和HI受热分解 | D. | 石英熔化和冰熔化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com