
| A. | 锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 稀硝酸和过量的铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 少量SO2气体通入NaOH溶液中:SO2+OH-=HSO3- |
分析 A.电子、电荷不守恒;
B.发生氧化还原反应生成碘化亚铁、碘、水;
C.反应生成硝酸亚铁、NO和水;
D.反应生成亚硫酸钠和水.
解答 解:A.锌片插入硝酸银溶液中的离子反应为Zn+2Ag+=Zn2++2Ag,故A错误;
B.Fe(OH)3溶于氢碘酸的离子反应为2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O,故B错误;
C.稀硝酸和过量的铁粉的离子反应为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故C正确;
D.少量SO2气体通入NaOH溶液中的离子反应为SO2+2OH-=SO32-+H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 | |
| B. | 同价态的阳离子,甲比乙的氧化性弱 | |
| C. | 甲不能跟稀盐酸反应放出氢气而乙能 | |
| D. | 将甲、乙作电极组成原电池时,甲是正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | I1 | I2 | I3 | I4 | I5 | I6 | I7 | |
| A的电离能 | 1402 | 2856 | 4578 | 7475 | 9445 | 53267 | … | |
| B的电离能 | 1012 | 1907 | 2914 | 4964 | 6274 | 21267 | 25431 | |
| 序号 | I8 | I9 | I10 | I11 | I12 | I13 | I14 | … |
| B的电离能 | 29872 | 35905 | 40950 | 46261 | 54110 | 59024 | 271791 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 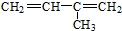 3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | B. | 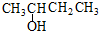 2-羟基丁烷 2-羟基丁烷 | ||
| C. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | D. | CH3CH(NH2)CH2COOH 3-氨基丁酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1 mol 氨气充分溶解在1L水中 | |
| B. | 将10克质量分数98%的硫酸与990克水混合 | |
| C. | 将25克胆矾溶于水配成1L 溶液 | |
| D. | 将10 mL1mol/L的盐酸与90 mL水充分混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸和稀氨水反应 | B. | 稀硫酸和烧碱溶液反应 | ||
| C. | 稀硫酸和氢氧化铜反应 | D. | 稀硫酸和氢氧化钡溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
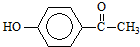 .这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )
.这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )| A. | 能跟氢氧化钠反应 | |
| B. | 能跟浓溴水反应 | |
| C. | 能跟碳酸氢钠反应 | |
| D. | 在催化剂存在时能被还原成含醇羟基的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA | |
| C. | 7.8gNa2O2中含有的阴离子数等于0.1NA | |
| D. | 标况下,2.24LH2O所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①⑤ | B. | 只有①②④⑤ | C. | 只有②③④⑤ | D. | ③②④⑤① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com